题目内容
【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
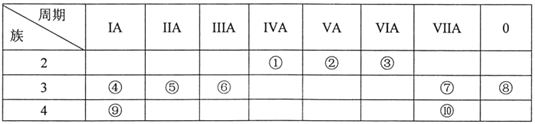
(1)上述10种元素中,化学性质最不活泼的是___(填元素符号,下同);与水反应最激烈的金属元素是___。
(2)元素①最高价氧化物的结构式是___;元素②的简单气态氢化物的电子式是___;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是___(填化学式)。
(3)①②⑤元素的原子半径由小到大的顺序为___(用元素符号表示);
(4)请用一个化学方程式(或离子方程式)说明元素⑦和⑩非金属性的强弱:___。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:___。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是___。
A.比较两种元素的单质的熔点、沸点高低
B.将打磨过的形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
C.比较两种元素的最高价氧化物对应的水化物碱性强弱
【答案】Ar K O=C=O 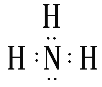 HClO4 N<C<Mg 2Br-+Cl2=Br2+2Cl- Al(OH)3+OH-=AlO2-+2H2O BC
HClO4 N<C<Mg 2Br-+Cl2=Br2+2Cl- Al(OH)3+OH-=AlO2-+2H2O BC
【解析】
根据所给元素周期表,①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素,据此分析。
(1)稀有气体元素的化学性质不活泼,故这10种元素中Ar的化学性质最不活泼;金属元素的金属性越强,其与水反应越剧烈,这10种元素中K的金属性最强,故K与水反应最剧烈;
(2)C元素的最高价氧化物为CO2,其结构为O=C=O;N元素的气态氢化物为NH3,其电子式为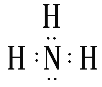 ;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,故这10种元素中酸性最强的是HClO4;
;元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,故这10种元素中酸性最强的是HClO4;
(3)三种元素原子,Mg的半径比Be大,Be的半径比C大,C的半径比N大,故Mg、C、N三种元素的半径从小到大为N<C<Mg;
(4)由于Cl的非金属性较强,故Cl2可以和Br-发生反应生成Br2和Cl-,离子方程式为2Br-+Cl2=Br2+2Cl-;
(5)NaOH和Al(OH)3发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(6)根据单质的熔、沸点不能比较元素的金属性,A错误;根据单质与水反应的现象可以比较元素的金属性,B正确;根据两种元素的最高价氧化物对应的水化物碱性可以比较元素的金属性,C正确;故答案为BC。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D