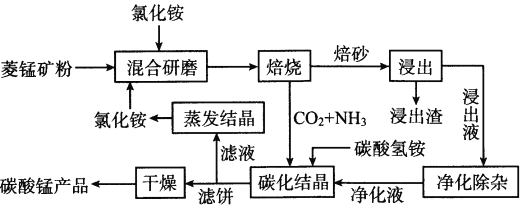
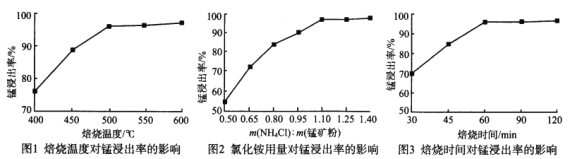
题目内容
【题目】请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。

(1)A极发生的电极反应式是___________ ,B极发生的电极反应式是_____________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接_____、 ____接______;B接______、_____接______ 。
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为_________________。
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8 mL(标准状况)。此时溶液OH- 浓度为___________。
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验。若甲烷通入量为2.24L(标准状况),且反应完全,则理论上电解池产生的为Cl2 的物质的量为______
【答案】A极反应式2H++2e-= H2 B极反应式是 2Cl--2e-=Cl2 G F H D E C Cl2+2I-=2Cl-+I2 0.03mol·L-1 0.4mol
【解析】
根据电解池的工作原理及本质分析解答;根据物质的量计算分析解答。
(1)A极应作阴极,H+放电,电极反应式是2 H++2e-=H2↑,B极是阳极,Cl-放电,电极反应式是2 Cl--2e-= Cl2↑电解饱和食盐水的化学方程式是2NaCl+2H2O![]() 2NaOH+ H2↑+ Cl2↑;故答案为:A极反应式2H++2e-= H2 ,B极反应式是 2Cl--2e-=Cl2;
2NaOH+ H2↑+ Cl2↑;故答案为:A极反应式2H++2e-= H2 ,B极反应式是 2Cl--2e-=Cl2;
(2) 收集氢气用排水集气法,所以A→G→F→H,验证氯气的氧化性用淀粉碘化钾溶液,剩余氯气用氢氧化钠溶液吸收,所以B→D→E→C,整体连起来为H、F、G、A、B、D、E、C;故答案为: G, F , H ,D,E,C ;
(3) 在盛有KI淀粉溶液的容器中发生反应是氯气置换碘的反应,离子方程式为Cl2+2I-=2 Cl-+2I2,故答案为:Cl2+2I-=2Cl-+I2;
(4) 根据方程式是2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可知2n(H2)=n(NaOH),其中n(H2)=0.00075mol,所以n(NaOH)=0.0015mol,c(NaOH)=0.03mol/L,故答案为:0.03mol.L-1
2NaOH+H2↑+Cl2↑,可知2n(H2)=n(NaOH),其中n(H2)=0.00075mol,所以n(NaOH)=0.0015mol,c(NaOH)=0.03mol/L,故答案为:0.03mol.L-1
(5) 甲烷共计是2.24L,物质的量是0.1mol,转移电子是0.8mol,所以根据电子的得失守恒可知,生成氯气是0.4mol,故答案为:0.4mol。