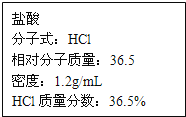
题目内容
【题目】下列图示与对应的叙述相符的是( )
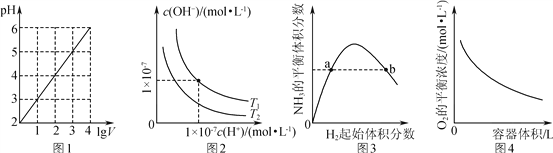
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
【答案】C
【解析】A. 醋酸是弱电解质,稀释促进电离,稀释10倍以后溶液的pH小于3,A错误;B. 电离吸热,加热促进水的电离,因此图中温度T2<T1,B错误;C. 增加氢气的浓度平衡向正反应方向进行,氮气的转化率增大,因此图中a点N2的转化率小于b点,C正确;D.由于体系中只有氧气是气体,则平衡常数K=c (O2),温度不变,平衡常数不变,因此氧气的浓度也不变,D错误,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目