题目内容
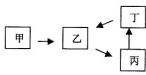 甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).
甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).(1)若丁的稀溶液与铜反应可生成乙,写出反应的离子方程式:
(2)若乙是难溶于水的酸性氧化物,写出工业上以乙为原料制取所含元素单质的化学方程式:
(3)若丙是离子化合物,且阴离子含有金属元素M.
①写出过量的二氧化碳通入丙溶液制取丁的离子方程式:
②以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖.人们在自然界中也找到了组成为M63Cu24Fe13的天然准晶体.将相同质量的此准品体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
A.n(烧碱)<n(稀硝酸)<n(盐酸) B.n(烧碱)<n(盐酸)<n(稀硝酸)
C.n(稀硝酸)<n(烧碱)<n(盐酸) D.n(盐酸)<n(稀硝酸)<n(烧碱)
(4)若乙含有第三周期元素A,2乙(g)+甲(g)?2丙(g)是工业生产中重要反应之一.
①写出实现NalO3+NaHAO3→I2+Na2AO4+H2AO4转化的配平并标明电子转移的方向和数目的化学方程式:
②已知:还原性HAO3->I-,若加入的NaHAO3过量,还可能与上述生成物中的
(1)若丁的稀溶液与铜反应可生成乙,则丁为硝酸,乙为NO,乙能和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,所以丙是NO;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,二氧化硅和氢氧化钠溶液反应生成硅酸钠,硅酸钠和盐酸反应生成硅酸,硅酸解热分解生成二氧化硅,所以丙是硅酸钠,丁是硅酸;
(3)若丙是离子化合物,且阴离子含有金属元素M,则阴离子为AlO2-,M为Al,甲是氧气,则乙是氧化物,则乙是氧化铝,偏铝酸钠和酸反应生成氢氧化铝,氢氧化铝分解生成氧化铝,所以丁是氢氧化铝;
(4)若乙含有第三周期元素A,2乙(g)+甲(g)?2丙(g)是工业生产中重要反应之一,则乙为SO2,丙为SO3,A为硫元素,丁是硫酸.
(1)若丁的稀溶液与铜反应可生成乙,则丁为硝酸,乙为NO,乙能和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,所以丙是NO,
铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)若乙是难溶于水的酸性氧化物,则乙为SiO2,二氧化硅和氢氧化钠溶液反应生成硅酸钠,硅酸钠和盐酸反应生成硅酸,硅酸解热分解生成二氧化硅,所以丙是硅酸钠,丁是硅酸,工业上用碳与二氧化硅反应生成硅与CO制备硅,反应方程式为:2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(3)若丙是离子化合物,且阴离子含有金属元素M,则阴离子为AlO2-,M为Al,甲是氧气,则乙是氧化物,则乙是氧化铝,偏铝酸钠和酸反应生成氢氧化铝,氢氧化铝分解生成氧化铝,所以丁是氢氧化铝,
①过量二氧化碳和偏铝酸钠溶液反应生成氢氧化铝和碳酸氢钠,离子方程式为:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓,
故答案为:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓;
②该合金中只有铝与氢氧化钠溶液反应生成气体,铁和铝都与盐酸反应生成氢气,所以加入盐酸放出的气体体积大于氢氧化钠溶液,铁、铝和铜都与稀硝酸反应生成气体,根据金属和生成气体之间的关系式得生成气体体积分别为:HCl:n(H2)=13+63×1.5=107.5 mol,NaOH:n(H2)=63×1.5=94.5 mol,HNO3:n(NO)=63+13+16=92 mol,所以生成气体体积大小顺序是n(稀硝酸)<n(烧碱)<n(盐酸),故选C.
(4)若乙含有第三周期元素A,2乙(g)+甲(g)?2丙(g)是工业生产中重要反应之一,则乙为SO2,丙为SO3,A为硫元素,丁是硫酸.
①NaIO3+NaHSO3→I2+Na2SO4+H2SO4,该反应中,I元素化合价由+5价变为0价,S元素化合价由+4价变为+6价,结合原子守恒得该反应方程式为4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,转移电子数目和方向为
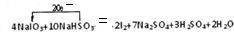 ,
,故答案为:
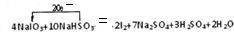 ;
;②还原性HSO3->I-,若加入的NaHSO3过量,亚硫酸氢根离子被碘氧化生成硫酸根离子,碘被还原生成碘离子,离子方程式为H2O+I2+HSO3-=2I-+SO42-+3H+,
故答案为:I2;H2O+I2+HSO3-=2I-+SO42-+3H+.

 全优点练单元计划系列答案
全优点练单元计划系列答案
| 甲 | 乙 | 丙 | 丁 |
化合物中各元素原子个数比 | A∶C | B∶A | D∶E | B∶E |
1∶1 | 1∶2 | 1∶3 | 1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个。在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,D和E的原子序数之和为30。
(1)写出元素符号:A___________,B___________,C___________,D___________,E___________。
(2)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(3)已知乙的式量小于甲,在实验室中常用什么方法制得乙:______________________
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式为______________________。
(5)向3 mL 1 mol·L-1KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL丁。经充分振荡后静置,可得到紫色溶液,这种紫色溶液是___________。
(9分)A、B、C、D、E五种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的不同周期邻族元素;D和E的原子序数之和为30。它们两两形成的化合物为甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:(用元素符号作答)
|
| 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
(1)写出A~E的元素符号
A: B: C: D: E:
(2)向甲的水溶液中加入MnO2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为:
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式是:

 。
。