题目内容
在0.1 mol·L-1Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是( )
A.c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B.c(Na+)=2[c( )+c( )+c( )+c(H2CO3)] )+c(H2CO3)] |
C.c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3) |
D.c(Na+)=c( )=c(OH-)=c(H+) )=c(OH-)=c(H+) |
D
Na2CO3溶液发生的变化有:Na2CO3电离:Na2CO3====2Na++
 水解:
水解:
 +H2O
+H2O
 +OH-
+OH-
 +H2O
+H2O H2CO3+OH-
H2CO3+OH-
Na2CO3溶液存在如下微粒:Na+,H+; ,
, ,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c(
,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式:
)+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式: ,
, ,H2CO3,故存在关系:c(Na+)=2[c(
,H2CO3,故存在关系:c(Na+)=2[c( )+c(
)+c( )+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、
)+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、 、H2CO3,故存在关系:c(OH-)=c(H+)+c(
、H2CO3,故存在关系:c(OH-)=c(H+)+c( )+2c(H2CO3);可知c(
)+2c(H2CO3);可知c( )<c(OH-),因此D不正确。
)<c(OH-),因此D不正确。

 水解:
水解: +H2O
+H2O
 +OH-
+OH- +H2O
+H2O H2CO3+OH-
H2CO3+OH-Na2CO3溶液存在如下微粒:Na+,H+;
 ,
, ,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c(
,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式:
)+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式: ,
, ,H2CO3,故存在关系:c(Na+)=2[c(
,H2CO3,故存在关系:c(Na+)=2[c( )+c(
)+c( )+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、
)+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、 、H2CO3,故存在关系:c(OH-)=c(H+)+c(
、H2CO3,故存在关系:c(OH-)=c(H+)+c( )+2c(H2CO3);可知c(
)+2c(H2CO3);可知c( )<c(OH-),因此D不正确。
)<c(OH-),因此D不正确。
练习册系列答案
相关题目
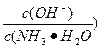 的值_________(填“增大”“减小”或“不变”)。
的值_________(填“增大”“减小”或“不变”)。 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+ +2H2O
+2H2O +H2O
+H2O
 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-) HCO-3+OH-。下列说法正确的是 ( )
HCO-3+OH-。下列说法正确的是 ( ) 不变
不变