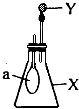题目内容
【题目】将6.4g铜与100g98%H2SO4在烧瓶中加热发生反应.
(1)铜完全溶解后,计算生成的气体在标准状况下的体积是多少?
(2)将反应后烧瓶中的物质配成500mL溶液. ①在配制过程中用到的仪器有;配制溶液时,若稀释后立即转移并定容,则所配得的溶液浓度(填“偏大”“偏小”或“不变”).
②求所配得溶液中H2SO4的物质的量浓度.
【答案】
(1)解:6.4gCu的物质的量为 ![]() =0.1mol,则:
=0.1mol,则:
Cu+2H2SO4(浓) | SO2↑+2H2O |
1 | 1 |
0.1mol | n(SO2) |
所以n(SO2)=0.1mol,故V(SO2)=0.1mol×22.4L/mol=2.24L
答:标准状况下SO2的体积是2.24L
(2)500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管;偏大
【解析】解:(2)配成500mL溶液所用仪器为:500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管. 配制溶液时,若稀释后立即转移并定容,没有恢复室温,溶液的温度偏高,恢复室温后溶液的体积偏小,结合c= ![]() 可知,所配溶液的浓度偏大,
可知,所配溶液的浓度偏大,
所以答案是:500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管,偏大;②原硫酸溶液中H2SO4的质量为100g×98%=98g,故原酸溶液中H2SO4的物质的量为 ![]() =1mol,
=1mol,
Cu+ | 2H2SO4(浓) |
1 | 2 |
0.1mol | 0.2mol |
计算所配溶液中n(H2SO4)=1mol﹣0.2mol=0.8mol,所配得溶液中H2SO4的物质的量浓度为 ![]() =1.6mol/L,
=1.6mol/L,
答:所配得溶液中H2SO4的物质的量浓度为1.6mol/L.
【考点精析】根据题目的已知条件,利用配制一定物质的量浓度的溶液的相关知识可以得到问题的答案,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.

 应用题作业本系列答案
应用题作业本系列答案