题目内容
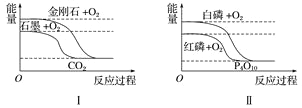
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是_____________。
(2)沉淀c的化学式是___________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_________________________。
【答案】 Cu、Fe BaCO3 ![]()
【解析】酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+。
(1)由以上分析可知沉淀a中含有的单质是Fe、Cu,故答案为:Fe、Cu;
(2)由分析可知沉淀c为BaCO3,故答案为:BaCO3;
(3)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O。

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
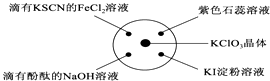
【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
A.A
B.B
C.C
D.D