题目内容
【题目】关于溶液的下列说法正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>①
C. 往0.lmol/L HCOOH溶液中通入少量HCl气体,甲酸的电离平衡向逆反应方向移动,且溶液中![]() 增大
增大
D. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
【答案】B
【解析】A、题目没有说明混合后溶液的酸碱性,如果溶液显酸性,说明HX的电离成成大于X-的水解,即c(X-)>c(Na+)>c(H+)c(OH-),如果溶液显碱性,说明X-的水解大于HX的电离,因此有c(Na+)>c(X-)>c(OH-)>c(H+),故A错误;B、①③为一组,碳酸为弱酸,HCO3-为弱酸酸式根,电离程度小,因此①③中CO32-的量小于②④,碳酸中的第一级电离,对第二级电离起到抑制作用,因此③中CO32-浓度大于①,②④为一组,②④为碳酸盐,④中(NH4)2CO3属于弱酸弱碱盐,互相促进水解,应④中CO32-的浓度小于②,因此有②>④>③>①,故B正确;C、HCOOH属于弱酸,部分电离,通入HCl气体,c(H+)增大,平衡向逆反应方向移动,但此比值是甲酸电离平衡常数的倒数,电离平衡常数只受温度的影响,即比值不变,故C错误;D、根据物料守恒,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D错误。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 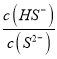 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体