题目内容
8.下列实验过程中.始终无明显现象的是( )| A. | NO2通FeSO4溶液中 | B. | NH3通入AlC13溶液中 | ||
| C. | CO2通入CaC12溶液中 | D. | SO2通人已酸化的Ba(NO3)2溶液中 |
分析 A.NO2和水反应生成NO和硝酸,硝酸可氧化FeSO4;
B.氨气水溶液呈碱性,可与氯化铝反应生成白色沉淀;
C.二氧化碳与氯化钙溶液不反应;
D.二氧化硫在酸化的硝酸钡溶液中被稀硝酸氧化生成硫酸钡沉淀分析.
解答 解:A.NO2和水反应生成NO和硝酸,硝酸具有强氧化性,可氧化FeSO4生成Fe3+,可观察到红棕色气体变为无色,溶液由浅绿色变成黄色,故A不选;
B.氨气水溶液呈碱性,可与氯化铝反应生成白色沉淀,故B不选;
C.二氧化碳与氯化钙溶液不反应,不能观察到明显现象,故C选;
D.二氧化硫在酸化的硝酸钡溶液中被稀硝酸氧化为硫酸,硫酸根离子结合钡离子生成硫酸钡沉淀,故D不选;
故选C.
点评 本题考查较为综合,涉及二氧化氮、氨气、二氧化硫以及沉淀的转化等知识,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大.

练习册系列答案
相关题目
18.使用下列能源会对环境造成污染的是( )
| A. | 风能 | B. | 石油 | C. | 氢能 | D. | 太阳能 |
19.a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可反应生成两个共价型g分子.
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 单位电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
试写出:
(1)d分子的空间构型为三角锥形.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:NaOH>Mg(OH)2 (用化学式表示).
(3)d溶于水的电离方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)g粒子所构成的晶体类型属分子晶体.
(5)c粒子是OH-,f粒子是H3O+(都用化学式表示).
16.下列离子方程式书写正确的是( )
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
3.电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是( )
| A. | H2和Cl2 | B. | Cu和 Cl2 | C. | H2和O2 | D. | Cu和O2 |
13.以乙醇为原料,合成乙二酸乙二酯(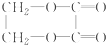 )所经历的反应的正确顺序是( )
)所经历的反应的正确顺序是( )
①氧化 ②消去 ③加成 ④酯化 ⑤水解 ⑥加聚.
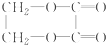 )所经历的反应的正确顺序是( )
)所经历的反应的正确顺序是( )①氧化 ②消去 ③加成 ④酯化 ⑤水解 ⑥加聚.
| A. | ①⑤②③④ | B. | ①②③⑤④ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
20.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | H2、I2、HI平衡混合气减小压强(扩大体积)可使颜色变浅 | |
| C. | 打开汽水瓶盖,有气泡冒出 | |
| D. | 在合成氨的反应中,加压有利于氨的合成 |
17.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3COOH→CH3COOC2H5 | B. | C2H5Cl→CH2=CH2 | ||
| C. | 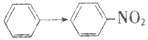 | D. | CH3CHO→C2H5OH |
18.完成下列各小题
(1)第34号元素符号是Se,铬元素位于元素周期表的d区(填“s、p、d、f、ds),其价层电子的轨道表示式(或电子排布图)为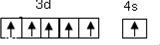
(2)用“>”或“<”填空
(3)在O、Na、P、Cl四种元素中,电负性最大的是O,PCl3的立体构型为三角锥形,中心原子的杂化轨道类型为sp3中心原子的价层电子对数为4
(4)在下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,共有4种(填数字)晶体类型,熔化时不需破坏化学键的是①⑤,(填序号,下同)熔化时只需破坏共价键的是④⑥.
(1)第34号元素符号是Se,铬元素位于元素周期表的d区(填“s、p、d、f、ds),其价层电子的轨道表示式(或电子排布图)为

(2)用“>”或“<”填空
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | O2->Na+ | CaO<MgO | HClO4>H2SO4 |
(4)在下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,共有4种(填数字)晶体类型,熔化时不需破坏化学键的是①⑤,(填序号,下同)熔化时只需破坏共价键的是④⑥.