题目内容
已知:①C(s) + O2(g)
O2(g) CO(g);△H =" –" 110.5 kJ · mol – 1
②C(s) + O2(g)
CO2(g);△H ="
–" 393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为 ( )
A.– 283.01 kJ · mol – 1 B.+ 172.51 kJ · mol – 1
C.+ 283.01 kJ · mol – 1 D.+ 504.00 kJ · mol – 1
【答案】
B
【解析】
试题分析:根据盖斯定律可知,①×2-②即得到C(s) + CO2(g) 2CO(g),所以该反应的△H=-110.5
kJ/mol×2+393.51 kJ/mol=172.51
kJ/mol,答案选B。
考点:考查反应热的计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生灵活运用盖斯定律解决实际问题的能力,有助于培养学生的逻辑推理能力,提高学生的应试能力。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下:
 TiCl4
TiCl4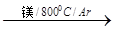 Ti
Ti  2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是