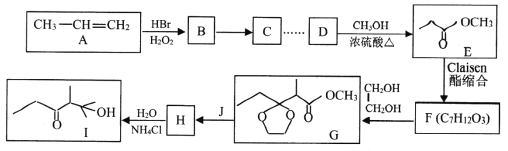
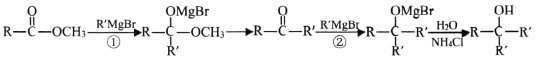
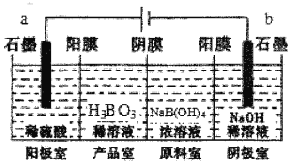
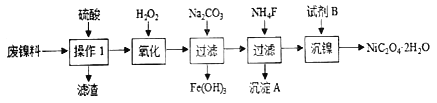
题目内容
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.开始时,正、逆反应同时开始
C.前2min内A的分解速率为0.1mol·L-1·min-1
D.2min时,A、B、C的浓度之比为2∶3∶1
【答案】B
【解析】
A.据图可知A浓度减小,应为反应物,B、C的浓度增大,应为生成物;相同时间内△c(A)=0.2mol/L,△c(B)=0.2mol/L,△c(C)=0.1mol/L,同一反应同一时段内反应速率之比等于计量数之比,所以A、B、C的计量数之比为0.2:0.2:0.1=2:2:1,所以反应方程式为2A(g)![]() 2B(g)+C(g),故A正确;
2B(g)+C(g),故A正确;
B.据图可知开始时C的浓度为0,所以此时逆反应速率应为0,故B错误;
C.前2min内△c(A)=0.2mol/L,所以A的分解速率为0.1mol·L-1·min-1,故C正确;
D.据图可知2min时,c(A)=0.2mol/L,c(B)=0.3mol/L,c(C)=0.1mol/L,浓度之比为2:3:1,故D正确;
故答案为B。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是________(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__________。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______,溶液中c(CH3COO-)/c(CH3COOH) =________。
(2)某温度下, PH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, PH=2的H2SO4与PH=11的NaOH混合后PH变为9,则硫酸与氢氧化钠的体积比为______.
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为_____。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=______(写出准确数值)。
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为_______;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈____。