题目内容
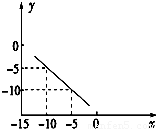
 在某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:
在某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:(1)该温度下,水的离子积为
10-15
10-15
.(2)该温度时,10L水中含OH-的物质的量为
10-6.5
10-6.5
mol,含H+的个数为10-6.5NA
10-6.5NA
个(设阿伏加德罗常数为NA)(3)该温度下,0.01mol/L NaOH溶液中c(H+)为
10-13mol/L
10-13mol/L
.欲使水电离产生的c(H+)=10-12 mol/L,配制1L溶液,应取5.0mol/L的盐酸溶液18×10-4
18×10-4
L.分析:(1)离子积常数=c(H+).c(OH-);
(2)根据n=VC计算氢氧根离子的物质的量,根据N=CVNA计算氢离子个数;
(3)根据离子积常数计算氢离子浓度,根据混合溶液中氢氧根离子浓度计算盐酸的浓度.
(2)根据n=VC计算氢氧根离子的物质的量,根据N=CVNA计算氢离子个数;
(3)根据离子积常数计算氢离子浓度,根据混合溶液中氢氧根离子浓度计算盐酸的浓度.
解答:解:(1)根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15,故答案为:10-15 ;
(2)纯水中氢离子浓度等于氢氧根离子浓度,则氢离子浓度=
×10-8 mol/L,则氢氧根离子的物质的量=10L×
×10-8 mol/L=10-6.5 mol,则氢氧根离子的个数为10-6.5NA,纯水溶液中氢离子个数等于氢氧根离子个数,所以氢离子个数是10-6.5NA,
故答案为:10-6.5,10-6.5NA;
(3)该温度下,氢氧化钠溶液中氢离子浓度=
mol/L=10-13mol/L,欲使水电离产生的c(H+)=10-12 mol/L,欲使水电离产生的c(H+)=10-12 mol/L,则混合溶液氢氧根离子浓度是0.001mol/,
设酸的体积为X,混合溶液中氢氧根离子浓度0.001mol/=
,则X=0.0018L
故答案为:10-13,18×10-4.
(2)纯水中氢离子浓度等于氢氧根离子浓度,则氢离子浓度=
| 10 |
| 10 |
故答案为:10-6.5,10-6.5NA;
(3)该温度下,氢氧化钠溶液中氢离子浓度=
| 10-15 |
| 0.01 |
设酸的体积为X,混合溶液中氢氧根离子浓度0.001mol/=
| 0.01mol/L×1L-5mol/L×X |
| 1L |
故答案为:10-13,18×10-4.
点评:本题考查了离子积常数的有关计算,注意纯水中氢离子浓度等于氢氧根离子浓度,为易错点.

练习册系列答案
相关题目
 在某温度下的水溶液中,c(H+)=10x mol?L-1,c(OH-)=10ymol?L-1,x与y关系如图所示.
在某温度下的水溶液中,c(H+)=10x mol?L-1,c(OH-)=10ymol?L-1,x与y关系如图所示.