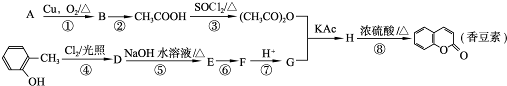题目内容
(2012?济南二模)下列叙述中,正确的是( )
分析:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子;
B.溶液中CO32-水解,其离子浓度小于1mol/L,根据n=cV、N=nNA进行判断;
C.根据n=
计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;
D.将250.0 g CuSO4?5H2O溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L.
B.溶液中CO32-水解,其离子浓度小于1mol/L,根据n=cV、N=nNA进行判断;
C.根据n=
| m |
| M |
D.将250.0 g CuSO4?5H2O溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L.
解答:解:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子,溶液中不存在HCl分子,故A错误;
B.溶液中CO32-水解,其离子浓度小于1mol/L,CO32-的物质的量小于1mol/L×1L=1mol,故CO32-所带电荷小于1mol×2×6.02×1023mol-1=2×6.02×1023,故B错误;
C.78.0gNa2O2的物质的量为
=1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol×
=0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
D.250.0 g CuSO4?5H2O的物质的量为
=1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;
故选C.
B.溶液中CO32-水解,其离子浓度小于1mol/L,CO32-的物质的量小于1mol/L×1L=1mol,故CO32-所带电荷小于1mol×2×6.02×1023mol-1=2×6.02×1023,故B错误;
C.78.0gNa2O2的物质的量为
| 78g |
| 78g/mol |
| 1 |
| 2 |
D.250.0 g CuSO4?5H2O的物质的量为
| 250g |
| 250g/mol |
故选C.
点评:本题考查常用化学计量的有关计算等,难度不大,注意A选项中不存在电解质分子.

练习册系列答案
相关题目