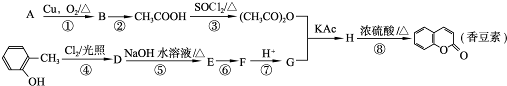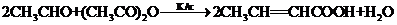题目内容
(2012?济南二模)有关下列两种溶液的说法中,正确的是( )
溶液①:0.2mol?L-1 CH3COONa溶液;
溶液②:0.1mol?L-1H2SO4溶液.
溶液①:0.2mol?L-1 CH3COONa溶液;
溶液②:0.1mol?L-1H2SO4溶液.
分析:A、溶液①是强碱弱酸盐溶液,醋酸根离子水解显碱性,促进水的电离:溶液②是酸溶液,对水的电离起到抑制作用;
B、加水稀释促进醋酸根离子的水解,但不改变水解平衡常数;
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,溶液中存在电荷守恒分析判断;
D、25℃时,溶液混合后PH=7,溶液呈中性,依据溶液中电荷守恒分析判断;
B、加水稀释促进醋酸根离子的水解,但不改变水解平衡常数;
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,溶液中存在电荷守恒分析判断;
D、25℃时,溶液混合后PH=7,溶液呈中性,依据溶液中电荷守恒分析判断;
解答:解:A、溶液①是强碱弱酸盐溶液,醋酸根离子水解显碱性,促进水的电离:溶液②是酸溶液,对水的电离起到抑制作用;相同温度下,溶液中水的电离程度:溶液①>溶液②,故A错误;
B、加水稀释促进醋酸根离子的水解,但不改变水解平衡常数;溶液中
不变,故B错误;
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,溶液呈酸性,溶液中存在电荷守恒分析判断;[Na+]+[H+]=[OH-]+[CH3COO-]+2[SO42-],若c[CH3COO-]+2[SO42-]=[Na+]得到[H+]=[OH-],不符合溶液呈酸性;故C错误;
D、25℃时,溶液混合后PH=7,溶液呈中性,溶液中存在电荷守恒;[Na+]+[H+]=[OH-]+[CH3COO-]+2[SO42-],[H+]=[OH-],c[CH3COO-]+2[SO42-]=[Na+],溶液中c(Na+)>c(SO42-),故D正确;
故选D.
B、加水稀释促进醋酸根离子的水解,但不改变水解平衡常数;溶液中
| c(CH3COOH)?c(OH-) |
| c(CH3COO-) |
C、溶液①和溶液②等体积混合恰好反应生成醋酸和硫酸钠,溶液呈酸性,溶液中存在电荷守恒分析判断;[Na+]+[H+]=[OH-]+[CH3COO-]+2[SO42-],若c[CH3COO-]+2[SO42-]=[Na+]得到[H+]=[OH-],不符合溶液呈酸性;故C错误;
D、25℃时,溶液混合后PH=7,溶液呈中性,溶液中存在电荷守恒;[Na+]+[H+]=[OH-]+[CH3COO-]+2[SO42-],[H+]=[OH-],c[CH3COO-]+2[SO42-]=[Na+],溶液中c(Na+)>c(SO42-),故D正确;
故选D.
点评:本题考查了影响水的电离平衡的影响因素,盐类水解的水解常数的分析应用,溶液中的电荷守恒应用,两种浓度大小比较的方法,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目