题目内容
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A. 高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
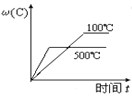
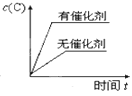
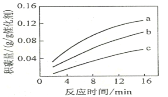
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________
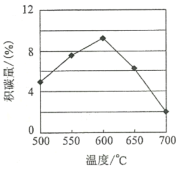
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
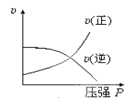
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·![]() (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
【答案】A ![]() 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD
劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD ![]() 、
、![]() 、
、![]()
【解析】
(1)根据盖斯定律计算;根据反应特点结合温度和压强对平衡状态的影响解答;根据转化率利用三段式计算平衡常数;
(2)①根据活化能对反应的影响分析;根据反应热结合温度对平衡状态的影响以及图像曲线变化趋势解答;
②根据反应速率方程式分析影响其因素结合图像解答。
(1)①该反应的正反应是反应前后气体体积增大的吸热反应,要使甲烷的转化率增大,可以通过减小压强、升高温度实现,故答案为A;
②
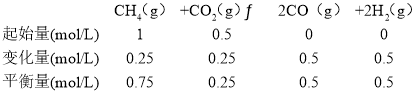
其平衡常数=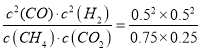 =
=![]() ;
;
(2)①消碳反应所需活化能越低,消碳反应越容易进行,催化剂活性越好,根据表中数据知,催化剂X较催化剂Y,积碳反应时,活化能低,反应速率快,消碳反应时,活化能高,反应速率慢,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性;
A.积碳反应和消碳反应的正反应都是吸热反应,升高温度平衡正向移动,则K积、K消均增加,故正确;
B.升高温度化学反应速率都增大,V积增加、V消增加,故错误;
C.积碳反应和消碳反应的正反应都是吸热反应,升高温度平衡正向移动,则K积、K消均增加,故错误;
D.积碳量达到最大值以后再升高温度积碳量降低,V消增加的倍数比V积增加的倍数大,故正确;
故答案为AD;
②在一定温度下,相同时间内,沉积的碳越多,则沉积碳生成速率越快,根据v=kp(CH4)[p(CO2)]-0.5(k为速率常数)知,p(CH4)一定时,沉积碳生成速率与二氧化碳压强成反比,根据图知,积碳量a>b>c,则pc(CO2)>pb(CO2)>pa(CO2)。

 开心蛙口算题卡系列答案
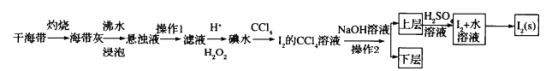
开心蛙口算题卡系列答案【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如图:
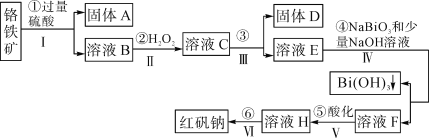
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是___。
(2)步骤③加的试剂为___,目的是将溶液pH要调到5使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
(3)写出反应④的离子反应方程式___。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程___。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是___(填操作名称)。