题目内容
铅蓄电池是典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42一 2PbSO4+2H2O。下列说法正确的是
2PbSO4+2H2O。下列说法正确的是
| A.放电时,负极的电极反应式是PbO2+4H++SO42一+2e一=PbSO4+2H2O |
| B.充电时,电解液中H2SO4的浓度将变小 |
| C.放电时,PbO2发生氧化反应 |
| D.充电时,蓄电池的正极和外接电源的正极相连 |
D
解析试题分析:A、放电时,Pb作负极,负极的电极反应式是Pb-2e-+ SO42一=PbSO4,错误;B、充电时,发生从右到左的反应,电解液中H2SO4的浓度将变大,错误;C、放电时,PbO2作正极,发生还原反应,错误;D、充电时,蓄电池的正极和外接电源的正极相连,正确,答案选D。
考点:考查可充电电池的反应原理

500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3—)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
| A.原混合溶液中n(K+)为2 mol |
| B.上述电解过程中共转移4 mol电子 |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(OH—)为2 mol/L |
下图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为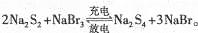 闭合开关K时,b极附近先变红色。下列说法正确的是
闭合开关K时,b极附近先变红色。下列说法正确的是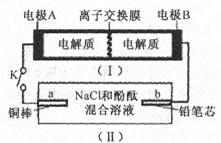
| A.当有0.01 mol Na+通过离子交换膜时,b电极上析出112 mL的气体 |
| B.负极反应为3Br--2e-= Br3- |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后.a电极上有氯气产生 |
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
| A.3 mol | B.4 mol | C.5 mol | D.6 mol |
下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是( )
| A.该电池工作过程中,H+浓度不断增大 |
| B.该电池在高温环境下能提供更好的动力 |
| C.该电池负极反应为:H2-2e-=2H+ |
| D.该电池正极反应为:O2+4e-=2O2- |
某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )。
| A.用铜片、铅笔芯作电极插入稀硫酸中 |
| B.用两个铜片作电极插入硝酸银溶液中 |
| C.用锌片、铜片作电极插入番茄中 |
| D.用铜片、铁片作电极插入酒精中 |
实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42—-2e-=PbSO4
正极:PbO2+4H++SO42—+2e-=PbSO4+2H2O
今欲制得Cl2 0.050 mol, 这时电池内消耗的H2SO4的物质的量至少是( )。
| A.0.025 mol | B.0.050 mol | C.0.10 mol | D.0.20 mol |
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
| A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq) |
| B.O2(g)+4H+(aq)+4e-=2H2O(l) |
| C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq) |
| D.O2(g)+2H2O(l)+4e-=4OH- |
工业上利用H2在Cl2中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
| A.两极材料都是石墨,用稀盐酸作电解质溶液 |
| B.通入氢气的电极为原电池的正极 |
| C.电解质溶液中的阳离子向通入氯气的电极移动 |
| D.通氯气的电极反应为Cl2+2e-=2Cl- |