题目内容
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
A
解析试题分析:化学反应中能量变化的主要原因是化学键的断裂与生成,A正确;铝热反应是放热反应, 所以反应物的总能量比生成物的总能量高,B不正确;图I所示的装置中没有形成闭合回路,不能构成原电池,因此不能将化学能转变为电能,C不正确;图II所示的反应中反应物的总能量高于生成物的总能量,为放热反应,D不正确,答案选A。
考点:考查化学反应中的能量变化、原电池的构成等
点评:该题是高考中的常见题型,属于中等难度试题的考查。主要是考查学生对化学反应中能量变化对的原因、影响反应热大小因素以及原电池构成条件的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,注意相关知识的积累和总结。

已知25℃、10lkPa条件下: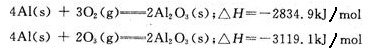
由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是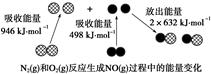
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是
| A.化学能部分转化为热能 | B.电能部分转化为化学能 |
| C.热能部分转化为化学能 | D.光能部分转化为化学能 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法正确的是
| A.CH3OH的燃烧为吸热反应 |
B.反应①中的能量变化如图所示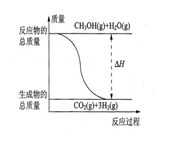 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H >-192.9kJ/mol |
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g) 2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
| A.该反应达到平衡时,放出的热量等于92.4kJ |
| B.达到平衡后向容器中通入1mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |