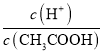题目内容
【题目】下列说法正确的是()
A.![]() 的纯水中,
的纯水中,![]()
![]()
B.向![]()
![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,![]() 、
、![]() 均增大
均增大
C.室温下,![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液等体积混合后溶液
的NaOH溶液等体积混合后溶液![]()
D.![]()
![]() 溶液中
溶液中![]()
【答案】B
【解析】
A.pH=6的纯水,c(H+)= c(OH—)=10-6mol/L,A项错误;
B.溶液中有Na2SO3水解平衡:![]() ,加入少量NaOH固体,使OH—浓度增大,平衡逆向移动,SO32—浓度增大,B项正确;
,加入少量NaOH固体,使OH—浓度增大,平衡逆向移动,SO32—浓度增大,B项正确;
C.pH=3的CH3COOH溶液与![]() NaOH溶液, c(H+)酸= c(OH—)碱,溶质c(CH3COOH)》c(NaOH),故等体积混合,酸远远过量,溶液呈现酸性pH<7,C项错误;
NaOH溶液, c(H+)酸= c(OH—)碱,溶质c(CH3COOH)》c(NaOH),故等体积混合,酸远远过量,溶液呈现酸性pH<7,C项错误;
D.在Na2CO3水溶液中水电离出的H+在溶液中以H+、HCO3—、H2CO3三种形式存在,其中1mol H2CO3分子中有2mol水电离出的氢离子,所以Na2CO3溶液中质子守恒:![]() ,D项错误;
,D项错误;
答案选B。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0