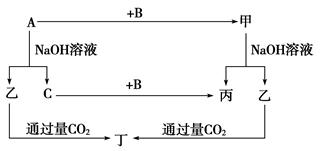
题目内容
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入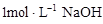
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
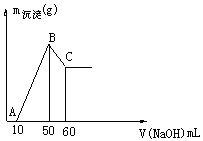
(1)合金中镁的质量 g铝的质量 g
(2)盐酸的物质的量浓度 mol/L
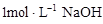
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。

(1)合金中镁的质量 g铝的质量 g
(2)盐酸的物质的量浓度 mol/L
(1)镁:0.12g (2分) 铝 :0.27g (2分)
(2) 0.5mol·L-1 (2分)
(2) 0.5mol·L-1 (2分)
试题分析:(1)根据图像可知,溶解氢氧化铝消耗的氢氧化钠溶液体积是60ml-50ml=10ml,则根据反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,氢氧化铝的物质的量是1mol/L×0.01L=0.01mol,因此根据原子守恒可知,铝的质量是0.01mol×27g/mol=0.27g;生成氢氧化铝消耗的氢氧化钠是溶解氢氧化铝消耗的氢氧化钠的3倍,则和铝离子反应的氢氧化钠是30ml,实验和镁离子反应的氢氧化钠是50ml-10ml-30ml=10ml。则根据反应式Mg2++2OH-=Mg(OH)2↓可知,氢氧化镁的物质的量是0.005mol,实验根据原子守恒可知,金属镁的质量是0.12g。
(2)根据图像可知,当沉淀达到最大值,消耗氢氧化钠是50ml,此时溶液中的溶质是氯化钠,物质的量是0.05mol,所以根据氯原子守恒可知,盐酸的物质的量是0.05mol,浓度是0.05mol÷0.1L=0.5mol/L。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和训练。该题的关键是掌握好守恒法在化学计算中的重要应用,常见的守恒法一般包括:质量守恒定律、电子的得失守恒、电荷守恒和原子守恒等。需要学生在平时的学习和训练中注意积累和总结。

练习册系列答案
相关题目
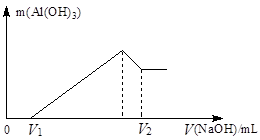
 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量