题目内容
过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。

步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为 。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是 。
(4)步骤5回收乙醇、乙醚时采用的操作方法是 。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42-
+I3-;I3- I2+I-;2S2O32-+I2=2I- +
S4O62-)
I2+I-;2S2O32-+I2=2I- +
S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是 。
②本实验所用的指示剂为 。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
(1)2KHSO4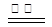 K2S2O8 + H2↑
K2S2O8 + H2↑
(2)O3
(3)降低水温,保证电解过程中温度在5℃以下
(4)蒸馏
(5)①防止I-被氧化,造成偏大的误差 ②淀粉溶液 ③54cV%
(6)2Mn2++5S2O82- +8H2O 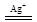 2MnO4- +10SO42- +16H+
2MnO4- +10SO42- +16H+
【解析】
试题分析:(1)电解KHSO4溶液,SO42 -失电子生成S2O82-,H+得电子生成H2。(2)阳极为阴离子放电,生成能氧化I-的气体,且为有色,则应为O3,可理解成OH-放电生成O2,O2在放电条件下进一步转化为O3。(3)由信息知,过二硫酸钾易分解,故需要在低温下生成。(4)乙醇和乙醚为相互溶解的有机物,可利用两者沸点不同而蒸馏分开。(5)I-易被氧化,如空气中的O2,故实验中需要封密。淀粉与I2显蓝色,该实验中当I2被消耗时,蓝色会褪去,从指示反应的终点。由方程式找出关系式:
K2S2O8~I3- ~I2~2S2O32 -
270 2
m(K2S2O8) cV10-3
w(K2S2O8)= m(K2S2O8)/0.25 =54cv%。
(6)Mn由+2价升到+7价,S由+7降到+6,根据得失电子守恒配平反应,再由电荷守恒确定出产物中有H+,最后由H原子守恒,确定反应物中还有H2O,并配平。
考点:制备实验、氧化还原反应、化学计算

(1)工业上用Na2SO3溶液处理工业尾气中的SO2,表中数据表示反应过程中
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
(2)已知Ki1(H2SO3)>Ki(HAc)>Ki2(H2SO3)>Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液.书写此反应的化学方程式:
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 …①;
I2+2S2O32-→2I-+S4O62-…②.
则S2O82-、S4O62-、I2氧化性强弱顺序:
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3-CClF2气体脱去HCl制得,生成0.5mol偏氟乙烯气体要吸收54kJ的热,写出反应的热化学方程式
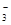 +4H++3e-→NO+2H2O
+4H++3e-→NO+2H2O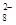 +2I-=2SO
+2I-=2SO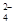 +I2
+I2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。