题目内容
将一定量的铝粉溶于过量的NaOH溶液中,再通入一定量CO2后,蒸干溶液并充分灼烧,得到固体物质的组成可能是( )
| A、Na2CO3、Al(OH)3、NaOH |
| B、Na2CO3、NaAlO2、Al2O3 |
| C、NaHCO3、NaAlO2、NaOH |
| D、Na2CO3、NaHCO3、Al2O3 |
考点:铝的化学性质
专题:几种重要的金属及其化合物
分析:铝粉溶于过量的NaOH溶液中,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,反应后溶质为NaOH和NaAlO2,再通入CO2,先发生CO2+2NaOH=Na2CO3+H2O,若二氧化碳过量,若CO2足量,那么先发生反应CO2+2NaOH=Na2CO3+H2O,然后发生反应2NaAlO2+CO2+3H2O=Naa2CO3+2Al(OH)3↓,以此来解答.
解答:
解:铝粉溶于过量的NaOH溶液中,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,反应后溶质为NaOH和NaAlO2,再通入CO2,先发生CO2+2NaOH=Na2CO3+H2O,若二氧化碳过量,若CO2足量,那么先发生反应CO2+2NaOH=Na2CO3+H2O,然后发生反应2NaAlO2+CO2+3H2O=Naa2CO3+2Al(OH)3↓,
蒸干溶液并充分灼烧,Al(OH)3、NaHCO3均分解,则一定不存在,说明A、C、D错误;
1)若CO2的量不足以将NaAlO2完全转化成Al(OH)3,那么溶液中为NaAlO2,Na2C03以及Al(OH)3沉淀,所以蒸干溶液并燃烧之后剩余固体为Na2CO3、NaAlO2、Al2O3;
2)如果CO2的量足以将NaAlO2完全转化成Al(OH)3并且还有剩余,那么CO2+H2O+Na2CO3=2NaHCO3,这样无论是否完全反应,最后固体为Na2CO3、Al2O3的混合物,
故选B.
蒸干溶液并充分灼烧,Al(OH)3、NaHCO3均分解,则一定不存在,说明A、C、D错误;
1)若CO2的量不足以将NaAlO2完全转化成Al(OH)3,那么溶液中为NaAlO2,Na2C03以及Al(OH)3沉淀,所以蒸干溶液并燃烧之后剩余固体为Na2CO3、NaAlO2、Al2O3;
2)如果CO2的量足以将NaAlO2完全转化成Al(OH)3并且还有剩余,那么CO2+H2O+Na2CO3=2NaHCO3,这样无论是否完全反应,最后固体为Na2CO3、Al2O3的混合物,
故选B.
点评:本题考查铝的化学性质及固体成分的判断,明确物质的性质及发生的反应为解答的关键,若抓住“蒸干溶液并充分灼烧”利用排除法可快速得到答案,题目难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列说法中正确的是( )
A、
| ||||||
| B、O2与O3互为同位素 | ||||||
| C、CH3-CH2-OH与CH3-O-CH3互为同分异构体 | ||||||
D、CH3-CH2-CH2-CH3与 互为同系物 互为同系物 |
下列关于可逆反应达到平衡状态的描述,正确的是( )
| A、反应停止 |
| B、正、逆反应速率都为零 |
| C、各物质浓度不再改变 |
| D、反应物的浓度为零 |
下列叙述正确的是( )
A、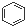 和 和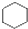 均是芳香烃, 均是芳香烃,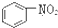 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
B、 和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| C、天然气、沼气、坑气、煤气的主要成分都是甲烷 |
| D、分子式为C4H10O的物质,可能属于醇类或醚类 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、K+、Ba2+、NO3-、Cl- |
| C、Na+、HCO3-、NO3-、SO42- |
| D、Fe3+、Na+、Cl-、SO42- |
下列化学反应的离子方程式正确的是( )
| A、FeCl3与氨水反应:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
| B、铜与稀硝酸反应:Cu+8H++2NO3-═Cu2++2NO↑+4H2O |
| C、NO2与水反应:3NO2+H2O═NO3-+NO+2H+ |
| D、醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
下列文字表述与反应方程式对应且正确的是( )
A、乙醇与乙酸在浓硫酸存在时加热的反应: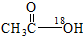 +CH3CH2OH +CH3CH2OH
 +H2O +H2O | |||
| B、碱性甲烷燃料电池的负极反应式为:CH4+10OH--8e-=CO32-+7H2O | |||
C、蔗糖在稀硫酸作催化剂时的水解反应:C12H22O11(蔗糖)+H2O
| |||
D、苯的硝化反应: +HNO3(浓) +HNO3(浓)
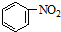 |
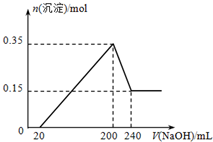 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol?L-1 NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.请通过计算回答:
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol?L-1 NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.请通过计算回答: