题目内容
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:(1)A极为电解槽的______ 极(正、负、阴、阳),电极反应式为______.
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3 ③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
(4)若将标准状况下6.72升阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5×6.02×1023,产物中得到了两种含氯化合物,写出该反应的离子方程式:______ 5Cl-+ClO3-+3H2O

【答案】分析:(1)电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;
(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
解答:解:(1)电解池中和电源的正极相连的是电解池的阳极,所以A极为电解槽的阳极,氯离子发生失电子的氧化反应,即2Cl-→2e-+Cl2↑,故答案为:阳;2Cl-→2e-+Cl2↑;
(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,故答案为:Na+;Cl-、OH-;
(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,故答案为:③②①④;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH-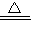 5Cl-+ClO3-+3H2O,反应中Cl元素的化合价由0价升高到+5价,0.3mol氯气参加反应,电子转移数是0.5×6.02×1023,
5Cl-+ClO3-+3H2O,反应中Cl元素的化合价由0价升高到+5价,0.3mol氯气参加反应,电子转移数是0.5×6.02×1023,
故答案为:3Cl2+6OH-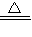 5Cl-+ClO3-+3H2O.
5Cl-+ClO3-+3H2O.
点评:本题主要考查学生电解池的工作原理知识,可以根据教材知识来回答,难度不大.
(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;
(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
解答:解:(1)电解池中和电源的正极相连的是电解池的阳极,所以A极为电解槽的阳极,氯离子发生失电子的氧化反应,即2Cl-→2e-+Cl2↑,故答案为:阳;2Cl-→2e-+Cl2↑;
(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,故答案为:Na+;Cl-、OH-;
(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,故答案为:③②①④;
(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH-
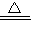 5Cl-+ClO3-+3H2O,反应中Cl元素的化合价由0价升高到+5价,0.3mol氯气参加反应,电子转移数是0.5×6.02×1023,
5Cl-+ClO3-+3H2O,反应中Cl元素的化合价由0价升高到+5价,0.3mol氯气参加反应,电子转移数是0.5×6.02×1023,故答案为:3Cl2+6OH-
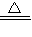 5Cl-+ClO3-+3H2O.
5Cl-+ClO3-+3H2O.点评:本题主要考查学生电解池的工作原理知识,可以根据教材知识来回答,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目

 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
