题目内容
【题目】化学反应中通常伴随着能量的变化,下列说法中错误的是( )。
A.煤燃烧时将部分化学能转化为热能
B.光合作用时将光能转化为电能
C.火药爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
【答案】B
【解析】煤是重要的能源,燃烧时放出大量的热能、光能等,A项正确;光合作用时,是将光能转化为化学能,而不是转化为电能,B项错误;火药爆炸时,部分化学能转化为动能,C项正确;镁条燃烧时放出大量的热,发出耀眼的白光,故镁条的部分化学能转化成了光能,D项正确。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:
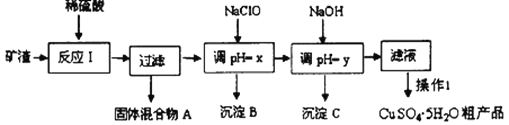
已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________。
(2)为了加快反应I的速率,可以采取的措施是______________(写1点)。
(3)固体混合物A中的成分是__________________________。
(4)反应I完成后,铁元素的存在形式为_______________(填离子符号);写出生成该离子的离子方程式___________________________________。
(5)x对应的数值范围是_______________________。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ molL-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________。
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
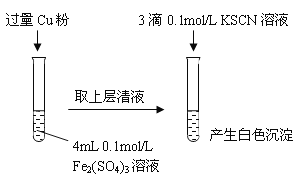
(1)Fe3+与Cu粉发生反应的离子方程式为______________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_______mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ. SCN-的化学性质与I-相似 ⅱ. 2Cu2+ + 4 I-= 2CuI↓+ I2
Cu2+与SCN-反应的离子方程式为_____________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2+ + NO ![]() Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
(3)用离子方程式解释NO 产生的原因_________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是__________________________________________________________________________。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因________________________________。