题目内容
“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
______C+______KMnO4+______H2SO4→______CO2↑+______MnSO4+______K2SO4______H2O
(2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)
得到表中三组数据
| 实验 | 温度°C | 起始量/mol | 平均量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可
以利用实验______的数据进行,其K=______.
(3)已知在常温常压下:
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H═44.0kJ/mol
写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式______.
故答案为:5;4;6;5;4;2;6;
(2)①由表中数据可知,6min平衡时H2的物质的量为1.6mol,故v(H2)=
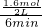 =0.13mol/(L?min),速率之比等于化学计量数之比,故v(CO2)=v(H2)=0.13mol/(L?min),故答案为:0.13mol/(L?min);
=0.13mol/(L?min),速率之比等于化学计量数之比,故v(CO2)=v(H2)=0.13mol/(L?min),故答案为:0.13mol/(L?min);②平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
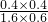 =0.17,
=0.17,故答案为:0.17;
(3)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol,
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol,
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
分析:(1)反应中C→CO2,碳元素化合价由0价升高为+4价,共升高4价,KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为20,故C的系数为5,故KMnO4系数为4,据此结合原子守恒配平其它物质的系数;
(2)①根据v=
 计算v(H2),再利用速率之比等于化学计量数之比计算v(CO2);
计算v(H2),再利用速率之比等于化学计量数之比计算v(CO2);②平衡常数只受温度影响,温度相同,同一反应平衡常数相同,可以利用实验2计算900℃平衡常数;
根据三段式计算平衡时各组分的物质的量,反应前后气体的化学计量数不变,利用物质的量代替浓度代入平衡常数表达式计算;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算,据此书写.
点评:本题考查较为综合,涉及氧化还原反应配平、反应速率计算、化学平衡常数、热化学方程式书写等,难度中等,是对学生能力的考查,注意掌握氧化还原反应配平方法、盖斯定律的运用等,学习中注意相关解答方法的积累.

“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
___C+____KMnO4+____H2SO4→___CO2↑+____MnSO4+____K2SO4+___H2O
(2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g)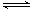 CO2(g)+H2(g) 得到表中三组数据
CO2(g)+H2(g) 得到表中三组数据
|
实验 |
温度℃ |
起始量/mol |
平均量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为____(取二位小数,下同)。
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可以利用实验____的数据进行,其K=____。
(3)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO(g) △H=-566.0kJ/mol
③H2O(g)=H2O(I) △H=-44.0kJ/mol
写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式_ 。
“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。
(1)将不同量的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g) 得到表中三组数据
CO2(g)+H2(g) 得到表中三组数据
| 实验 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
请计算:
①实验1中v(CO2)?(取二位小数,下同)。
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可以利用实验____的数据进行,求其平衡常数K?
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO(g) △H=-566.0kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
写出甲醇(CH2OH)不完全燃烧生成一氧化碳和液态水的热化学方程式_ 。