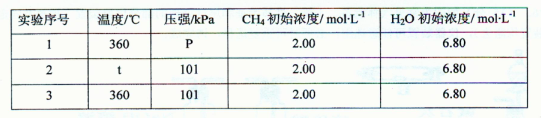
题目内容
某温度时,把1molN2O4气体通入体积为5L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.6倍。
(1)、前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)、在4s时容器内的压强为开始时的 倍
(3)、在平衡时容器内含N2O4 mol
(4)、在平衡时容器内NO2的浓度为 mol/L
(5)、N2O4的转化率为
(1)、前4s中以N2O4的浓度变化表示的平均反应速度为 mol/L·s
(2)、在4s时容器内的压强为开始时的 倍
(3)、在平衡时容器内含N2O4 mol
(4)、在平衡时容器内NO2的浓度为 mol/L
(5)、N2O4的转化率为
0.005mol/L·s;1.1倍;0.4mol;0.24mol/L 60%
反应进行到4秒时,NO2的浓度为0.04摩/升,则此时NO2的反应速率是0.01mol/(L·s)。由于速率之比是化学计量数之比,因此N2O4的浓度变化表示的平均反应速度为0.005摩/升·秒。4s时NO2的物质的量是0.2mol,消耗N2O4是0.1mol,所以此时体系内压强为开始时压强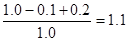 。设平衡时生成NO2是xmol,则消耗N2O4是X/2mol,因此有
。设平衡时生成NO2是xmol,则消耗N2O4是X/2mol,因此有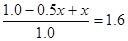 ,解得x=1.2,所以平衡时N2O4的物质的量是1.0mol-0.5×1.2mol=0.4mol,NO2的浓度是
,解得x=1.2,所以平衡时N2O4的物质的量是1.0mol-0.5×1.2mol=0.4mol,NO2的浓度是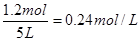 ,N2O4的转化率为
,N2O4的转化率为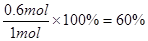 。
。
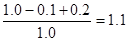 。设平衡时生成NO2是xmol,则消耗N2O4是X/2mol,因此有
。设平衡时生成NO2是xmol,则消耗N2O4是X/2mol,因此有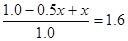 ,解得x=1.2,所以平衡时N2O4的物质的量是1.0mol-0.5×1.2mol=0.4mol,NO2的浓度是
,解得x=1.2,所以平衡时N2O4的物质的量是1.0mol-0.5×1.2mol=0.4mol,NO2的浓度是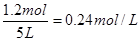 ,N2O4的转化率为
,N2O4的转化率为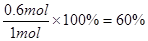 。
。
练习册系列答案
相关题目
 NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
NH4++NH2—,NH4+的平衡浓度为1×10-15mol·L-1,下列说法错误的是( )
 2SO3 (g) ;△H<0
2SO3 (g) ;△H<0 B(g)+2C(g),增大压强反应速率加快,A的转化率减小
B(g)+2C(g),增大压强反应速率加快,A的转化率减小 2SO3,已知V(SO2)==0.05mol·l-1·min-1,则2min后SO3的浓度为( )
2SO3,已知V(SO2)==0.05mol·l-1·min-1,则2min后SO3的浓度为( ) 。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
。H2应从电解池的________ (填电极名称)通入;其中b电极的电极反应方程式为________。
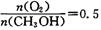 时,制备反应分两步进行,其中一步是
时,制备反应分两步进行,其中一步是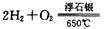
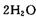 ,则另一步是____________ (写化学方程式)。
,则另一步是____________ (写化学方程式)。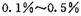 的HCHO可用于杀菌消毒,其原因是________。
的HCHO可用于杀菌消毒,其原因是________。 CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。