题目内容
【题目】有X、Y、Z、W四种短周期元素,它们的核电荷数依次增大.只有Z是金属元素,X最外层只有一个电子,Y和W元素原子的最外层电子数相同,且Y元素原子L 层电子数是K层电子数的3倍,Z元素原子的最外层电子数是W元素原子最外层电子数的一半.请回答:
(1)Z是(填元素符号),W的原子结构示意图为 .
(2)写出两种仅由X、Y两种元素的原子形成的10电子微粒的符号 .
(3)己知标准状况下,2gX的单质气体在Y的单质气体(空气主要成分之一)中充分燃烧放出285.8kJ的热量,该反应的热化学方程式为 .
(4)将X的单质气体与Y的单质气体间的反应设计成原电池反应,简易装置如图所示.A处通入的气体为 , B处气体发生反应的电极反应式为 . 
【答案】
(1)Al;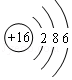
(2)H2O、OH﹣
(3)2H2(g)+O2(g)=2H2O(1)△H=﹣285.8kJ?mol﹣1
(4)H2;O2+4e﹣+4H+=2H2O
【解析】解:(1)有X、Y、Z、W四种短周期元素,它们的核电荷数依次增大,X最外层只有一个电子,X不是金属元素,X为H,Y元素原子L层电子数是K层电子数的3倍,则Y为O元素;W和Y元素原子的最外层电子数相同,则W为S;Z元素原子的最外层电子数是W元素原子最外层电子数的一半,则Z为B或Al,又Z是金属元素,则Z只能为Al,W为S,核外电子分三层排布,分别为2、8、6,原子结构示意图为  ,所以答案是:Al;
,所以答案是:Al;  ;(2)X、Y分别为:H、O,形成的氢化物H2O含有10个电子,形成的OH﹣含有10个电子,所以答案是:H2O、OH﹣;(3)2gH2的单质的物质的量为n=
;(2)X、Y分别为:H、O,形成的氢化物H2O含有10个电子,形成的OH﹣含有10个电子,所以答案是:H2O、OH﹣;(3)2gH2的单质的物质的量为n= ![]() =
= ![]() =1mol,燃烧放出285.8kJ的热量,当2molH2燃烧时,反应热应为△H=(﹣285.8kJmol﹣1)×2=﹣571.6KJ/mol,热化学方程式为2H2(g)+O2(g)=2H2O(1)△H=﹣285.8kJmol﹣1 , 所以答案是:2H2(g)+O2(g)=2H2O(1)△H=﹣285.8kJmol﹣1;(4)根据电子的流向,A处负极电子流出,发生氧化反应,电极方程式为2H2﹣4e﹣=4H+ , 所以A处通入的气体为H2 , 氧气具有氧化性,通入氧气的一极为原电池的正极,正极发生还原反应,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:H2;O2+4e﹣+4H+=2H2O.
=1mol,燃烧放出285.8kJ的热量,当2molH2燃烧时,反应热应为△H=(﹣285.8kJmol﹣1)×2=﹣571.6KJ/mol,热化学方程式为2H2(g)+O2(g)=2H2O(1)△H=﹣285.8kJmol﹣1 , 所以答案是:2H2(g)+O2(g)=2H2O(1)△H=﹣285.8kJmol﹣1;(4)根据电子的流向,A处负极电子流出,发生氧化反应,电极方程式为2H2﹣4e﹣=4H+ , 所以A处通入的气体为H2 , 氧气具有氧化性,通入氧气的一极为原电池的正极,正极发生还原反应,电极方程式为O2+4e﹣+4H+=2H2O,所以答案是:H2;O2+4e﹣+4H+=2H2O.

【题目】实验室需要配制0.55mol·L-1NaOH溶液220mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、。
(2)计算。配制该溶液需取NaOH晶体。
(3)称量。
①天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:![]() (1g以下用游码):
(1g以下用游码):
②称量过程中NaOH晶体应放于天平的(填“左盘”或“右盘”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,应注意;需要洗涤烧杯2~3次是为了 。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有(填字母,下同);无影响的有。
A.称量时用生锈的砝码 |
B.将NaOH放在纸上称量 |
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
D.往容量瓶转移时有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥就用来配制溶液
