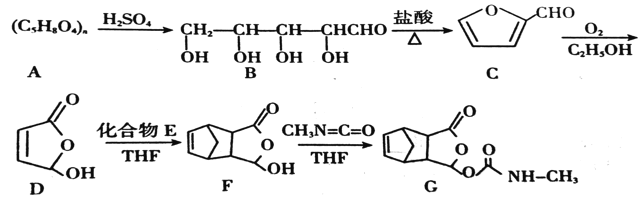
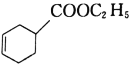
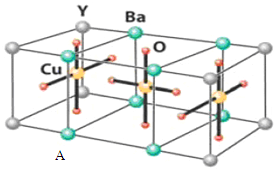
题目内容
【题目】在一定温度下,在1L密闭容器中加amolSO2和bmolO2发生反应2SO2+O2![]() 2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
(1)生成___molSO3;
(2)O2的转化率为___;
(3)平衡时容器内气体的总物质的量为___mol;
(4)达到平衡时,c(SO2)=___mol/L。
【答案】c ![]() % (a+b﹣0.5c) (a﹣c)
% (a+b﹣0.5c) (a﹣c)
【解析】
依据化学平衡三段式列式计算
2SO2+O2![]() 2SO3
2SO3
起始量(mol) a b 0
变化量(mol) c 0.5c c
平衡量(mol) a-c b-0.5c c
据此分析计算。
依据化学平衡三段式列式计算
2SO2+O2![]() 2SO3
2SO3
起始量(mol) a b 0
变化量(mol) c 0.5c c
平衡量(mol) a-c b-0.5c c
(1)计算可知,反应生成三氧化硫物质的量为cmol;
(2)O2的转化率=![]() ×100%=
×100%=![]() %;
%;
(3)平衡时容器内气体总物质的量=a-c+b-0.5c+c=(a+b-0.5c)mol;
(4)平衡浓度c(SO2)=![]() =(a-c)mol/L。
=(a-c)mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验“操作和现象”与“结论”对应关系正确的是![]()
操作和现象 | 结论 | |
A | 常温下,将Al箔插入浓 | 铝和浓硝酸不反应 |
B | 向饱和 | 析出了 |
C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 向装有 |
|
A.AB.BC.CD.D
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)=4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应,随着反应的进行,容器内的压强变化如表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?___(填“增大”、“减小”或“不变”),原因是____。