题目内容
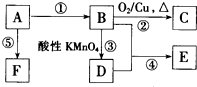
8.A~G各物质间的关系如下图,其中A是发酵粉的主要成分,C、F常温常压下是气体,E是淡黄色固体.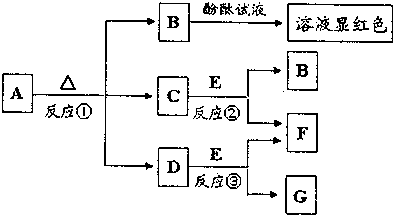
请回答下列问题:
(1)A的俗名是小苏打,G的电子式是
 ;
;(2)反应②的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;;
(3)鉴别A、B两物质水溶液的常用试剂是氯化钙溶液;
(4)C是一种常见的温室气体,在自然界循环时可与CaCO3反应.CaCO3是一种难溶物质,其KSP(CaCO3)=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-3mol/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-6mol/L.
分析 A是发酵粉的主要成分,加热分解C常温常压下是气体,得B的溶液能使酚酞显红色,所以A为NaHCO3,进而推得C为CO2,B为Na2CO3,D为H2O,E是淡黄色固体,能与水和二氧化碳反应,所以E为Na2O2,则F为O2,G为NaOH,据此答题.
解答 解:A是发酵粉的主要成分,加热分解C常温常压下是气体,得B的溶液能使酚酞显红色,所以A为NaHCO3,进而推得C为CO2,B为Na2CO3,D为H2O,E是淡黄色固体,能与水和二氧化碳反应,所以E为Na2O2,则F为O2,G为NaOH,
(1)A为NaHCO3,A的俗名是小苏打,G为NaOH,其电子式是 ,
,
故答案为:小苏打; ;
;
(2)反应②的化学方程式是2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)A为NaHCO3,B为Na2CO3,鉴别A、B两物质水溶液的常用试剂是氯化钙溶液,
故答案为:氯化钙溶液;
(4)因为KSP(CaCO3)=2.8×10-9所以将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-3mol/L,则混合后Na2CO3溶液的浓度为1×10-3mol/L,所以生成沉淀时混合溶液中所需CaCl2溶液的最小浓度为$\frac{{K}_{SP}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-3}}$mol/L=2.8×10-6mol/L,所以在混合前CaCl2溶液的最小浓度为5.6×10-6mol/L,
故答案为:5.6×10-6.
点评 本题考查无机物的推断,题目难度中等,注意根据物质的颜色、反应的现象为突破口进行推断,学习中注意元素化合物的性质,注重相关知识的积累.

| A. | 乙烯的结构简式:C2H4 | B. | NH4Br的电子式: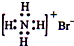 | ||
| C. | S2-的结构示意图: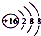 | D. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl |
| A. | H2O | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
| A. | 工业生产纯碱 | B. | 金属铝的冶炼 | C. | 海水中提取溴 | D. | 工业生产玻璃 |
| 族 | LA | 0 | ||||||
| 周期 | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)下列事实能证明②的非金属性比⑥强的是CD
A:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
B:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
C:Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3;
D:CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式

(4)③、④、⑤的形式的简单离子半径依次减小(填“增大”、“减小”或“不变”)
(5)①、②、⑦三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
 已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物.
已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物. CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$
CH3COOC2H5+H2O;⑤nCH2=CH2$\stackrel{催化剂}{→}$ .
.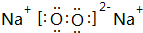 ,其中含有的化学键为离子键和共价键;
,其中含有的化学键为离子键和共价键;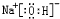 、
、 .
.