题目内容
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题:
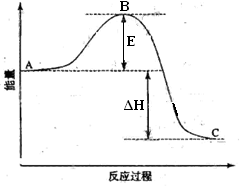
(1)图中A、C分别表示___________、___________;
(2)图中△H= ___________KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,写出表示硫燃烧的热化学方程式 ___________;
(4)计算由S(s)生成3 molSO3(g)的△H = ___________ 。

(1)图中A、C分别表示___________、___________;
(2)图中△H= ___________KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,写出表示硫燃烧的热化学方程式 ___________;
(4)计算由S(s)生成3 molSO3(g)的△H = ___________ 。
(1)反应物能量 生成物能量(每空2分)
(2)-198(2分)
(3) S(s)+O2(g) =SO2(g) △H1=-296 KJ·mol-1(3分)
(4)△H=-1185 KJ·mol-1(3分)
(1)根据图像可知A点表示反应物的总能量,C点表示生成物的总能量。
(2)1mol SO2(g)氧化为1mol SO3的ΔH= —99kJ·mol-1.而在图像中表示的是生成2mol SO3的能量变化示意图,所以反应热是—198kJ·mol-1.
(3)燃烧热是在一定条件下1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式为S(s)+O2(g) =SO2(g) △H1=-296KJ·mol-1。
(4)硫的燃烧热为296 kJ/mol,所以热化学方程式为①S(s)+O2(g)=SO2(g)△H=-296kJ·mol-1。将该反应和反应②2SO2(g)+O2(g)
 2SO3(g) △H=-198kJ·mol-1叠加,即①×2+②得到2S(s)+3O2(g)=2SO3(g),所以该反应的△H=-790kJ·mol-1。因此生成3mol三氧化硫气体放出的热量是
2SO3(g) △H=-198kJ·mol-1叠加,即①×2+②得到2S(s)+3O2(g)=2SO3(g),所以该反应的△H=-790kJ·mol-1。因此生成3mol三氧化硫气体放出的热量是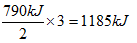 。
。
练习册系列答案
相关题目
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )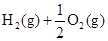 ══
══

 ══
══

 ══2CO2(g)+2H2O(l)
══2CO2(g)+2H2O(l)
 ══
══



 稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( ) )+
)+ H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol
H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol