题目内容
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是 ,该装置中发生反应的化学方程式为 。
(2)实验过程中,装置乙、丙中出现的现象分别是 ;装置丙中的试管内发生反应的离子方程式为 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是 。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为 色。

请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是 ,该装置中发生反应的化学方程式为 。
(2)实验过程中,装置乙、丙中出现的现象分别是 ;装置丙中的试管内发生反应的离子方程式为 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是 。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为 色。
(1)分液漏斗(答漏斗不得分) Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)出现红棕色气体 出现无色气体、蒸馏水中有气泡 3NO2+H2O=2H++2NO+NO
(3)氧气
(4)黄 红
(2)出现红棕色气体 出现无色气体、蒸馏水中有气泡 3NO2+H2O=2H++2NO+NO
(3)氧气
(4)黄 红
(1)在浓硝酸与铜的反应中,需要随时控制浓硝酸的流量,故采用分液漏斗,而不是一般的漏斗;浓硝酸与铜反应生成二氧化氮。
(2)二氧化氮为红棕色气体,能够与水反应生成无色的一氧化氮。
(3)一氧化氮与氧气反应表现还原性,被氧化为二氧化氮。
(4)试管D中的溶液为稀硝酸,稀硝酸具有氧化性,能够将亚铁离子氧化为铁离子,铁离子与SCN-生成红色的物质。
(2)二氧化氮为红棕色气体,能够与水反应生成无色的一氧化氮。
(3)一氧化氮与氧气反应表现还原性,被氧化为二氧化氮。
(4)试管D中的溶液为稀硝酸,稀硝酸具有氧化性,能够将亚铁离子氧化为铁离子,铁离子与SCN-生成红色的物质。

练习册系列答案
相关题目

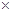 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中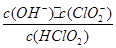 = 。
= 。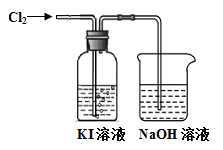
 I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性
