题目内容
【选修3-物质的结构与性质】(15分)
上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。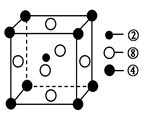
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。
(1) 3d104s1 (1分) Cr (1分) 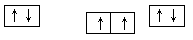
(1分)
(2) 过氧化氢 (1分) 直线型 (1分) MgNi3C或Ni3MgC (2分)
甲醇分子间存在氢键,而丙烯分子间只有范德华力 (2分)
(3)ac (2分)
(4)先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色 (2分)
(5 ) 0.92/a3或5.56×1023/(a3NA) (2分)
解析试题分析:(1)⑨号元素为铜元素,基态原子的价电子排布式是3d104s1,与其同周期,且基态原子的核外未成对电子数最多的元素的电子排布式为[Ar]3d54s1是Cr,②号元素为碳元素,基态原子的电子排布图 
(2) ①号元素氢与③号元素氧形成的含有18电子的物质为过氧化氢,②号元素碳与③号元 素氧形成的,能造成温室效应的物质二氧化碳的空间构型为直线型。根据晶胞的结构利用切割法判断,1个晶胞中含有1个碳原子,镁原子8×1/8=1个,镍原子6×1/2=3个,C、Mg、Ni三种元素的原子形成的晶体的化学式为MgNi3C或Ni3MgC,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是甲醇分子间存在氢键,而丙烯分子间只有范德华力。
(3)C、H两种元素能形成多种平面形分子,其中有一种相对分子质量最小为 乙炔,a.该分子中碳氢键为极性键,分子结构对称,属于含有极性键的非极性分子,正确;b.该分子含有2个碳氢键和1个碳碳三键,共3个σ键和2个π键,错误;c.该分子为直线型,碳原子采取sp1杂化,错误;d、该物质微溶于水,错误,选a;
(4)某元素的价电子排布式为nsnnpn+1,该元素为氮元素,可与元素氢形成含有10个电子的分子氨气,将过量的氨气通入盛有硫酸铜溶液的试管里,先发生复分解反应后发生络合反应,产生的现象为先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色。
(5) 根据晶胞的结构先确定1个晶胞中含有各原子的个数,进一步确定化学式,结合密度的定义及相关数学知识进行计算。无法确定D元素,无法计算
考点:考查元素周期表的结构、核外电子排布规律、晶体结构与性质。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_______。
(2)元素W的离子结构示意图为_________。
(3)元素R的最高价氧化物的电子式为_________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为_________,将A 溶于水,其水溶液中离子浓度由大到小的顺序是_______________ 。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是 。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式__________ 。
下表是元素周期表的一部分,根据表中10种元素,用元素符号或化学式填空。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | | ② | | |
| 3 | | | ③ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | ⑨ | ⑧ | | | | ⑩ | | |
(1)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。
(2)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ;
(3)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ;
(4)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 。
(14分)元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。


 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。