��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣�����������ĸA��D��F��G��Q��M��R��N��T�ֱ����ij�ֻ�ѧԪ�ء���������9��Ԫ�ػش���������
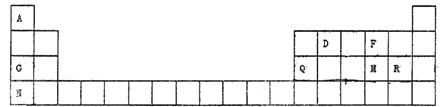
(1)��������ǿ��Ԫ����_______(��Ԫ�ط���),д����������Ԫ�ص��������о������Ե������������������Ԫ���м�����ǿ������������ˮ��������ӷ�Ӧ:____________________��
(2)Ԫ�صķǽ�����:M_____R(�>����<��)��
(3)R������������Ӧˮ����Ļ�ѧʽ��__________________________��
(4)F��G��Ԫ���γɵĵ���ɫ�������ʵĵ���ʽΪ_______�������ʺ��еĻ�ѧ����������____________________��
(5)����ijЩԪ�ص�ԭ�ӿ��γ���Ar������ͬ���Ӳ�ṹ�ļ����ӣ���Щ���ӵİ뾶�ɴ�С��˳����________________(�����ӷ���)��
(6)����ijԪ��ԭ�ӵĺ�����Ӳ�����������������3������Ԫ�ص�ԭ�ӽṹʾ��ͼΪ____________________________________��
���𰸡� K Al2O3+3H2O+2OH-=2[Al(OH)4]- < HC1O4 ![]() ���Ӽ������ۼ� S2->Cl->K+
���Ӽ������ۼ� S2->Cl->K+ 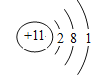
������������Ԫ�����ڱ���Ԫ�������ɵ����ã���1��ͬ������ϵ��½�������ǿ��ͬ���ڴ������ҽ����Լ���������������ǿ����N��NΪK���������Ե���������Al2O3������������ˮ����ļ�����ǿ����KOH�����������ӷ�Ӧ����ʽΪAl2O3��2OH����3H2O=2[Al(OH)4]������2��MΪS��RΪCl��ͬ���ڴ������ҷǽ�������ǿ����Cl>S����3��Cl������������Ӧˮ����Ļ�ѧʽΪHClO4����4��FΪO��GΪNa���γɵ���ɫ��������ΪNa2O2�������ʽΪ![]() �����л�ѧ��Ϊ���Ӽ��ͷǼ��Թ��ۼ�����5�����γ���Ar������ͬ���Ӳ�ṹ�ļ�������S2����Cl����K����������Ӱ뾶��С˳����S2��>Cl��>K������6��ijԪ�ص�ԭ�ӵĺ�����Ӳ�����������������3��������Ԫ��ΪNa��ԭ�ӽṹʾ��ͼΪ
�����л�ѧ��Ϊ���Ӽ��ͷǼ��Թ��ۼ�����5�����γ���Ar������ͬ���Ӳ�ṹ�ļ�������S2����Cl����K����������Ӱ뾶��С˳����S2��>Cl��>K������6��ijԪ�ص�ԭ�ӵĺ�����Ӳ�����������������3��������Ԫ��ΪNa��ԭ�ӽṹʾ��ͼΪ ��
��

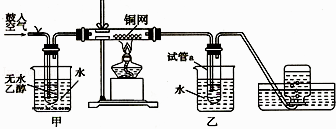
����Ŀ����ij��Һ������Fe2+��Cu2+��Cl�����л���ͭ���Ƶô�����FeCl3��Һ�������Ƶô�����FeCl3��ҺΪԭ����ȡ������ˮ������������أ�K2FeO4������������ͼ�� 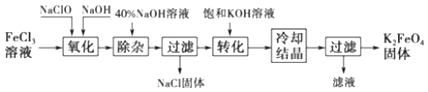
��֪��������أ�K2FeO4��λ����ɫ���壬������ˮ�������Ի�������Һ���ֽ⣬�ڼ�����Һ���ȶ���������ؾ���ǿ�����ԣ�������أ�K2FeO4����ˮ���ò���Fe��OH��3 ��
��1�������Һ�к���Fe2+ѡ�õ��Լ������ѧʽ�����ӷ�Һ���Ƶô�����FeCl3��Һ������Լ��������⣬����Ҫһ���Լ������ѧʽ��������ʱ������Ӧ�����ӷ���ʽΪ ��
��2��������أ�K2FeO4���ڴ���ˮ�����е��������� ��
��3�������������̷�Ӧ�����ӷ���ʽΪ ��
��4������ʱ���õIJ��������в��������ձ��� �� �������յõ��ĸ�����س�������־�������ؽᾧ���ᴿ�������ǣ����ֲ�Ʒ���ܽ⣬Ȼ�� ��
��5���û��յ�ͭΪԭ�Ͽ��Ƶô���CuSO45H2O���壨����������FeSO47H2O������ȥCuSO45H2O��������־�ķ����ǣ�����Һ�м���H2O2 �� �ٵ�����ҺpH�����˼����Ƶô�����CuSO4��Һ�������Ƶô���CuSO45H2O�ľ��壮 ��֪������ʱһЩ���ʵ�Kaq�����
��ѧʽ | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
Kaq | 8.0��10��16 | 8.0��10��18 | 8.0��10��20 |
��֪��Һ�е�����Ũ��С��1��10��6molL��1ʱ���϶�������ȫ��
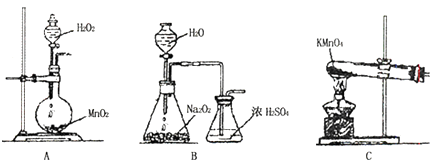
��˫��ˮ��Ŀ����������Һ��CuSO4��Ũ��Ϊ3.0molL��1 �� ͨ������˵���˷����ɳ�ȥ����CuSO45H2O������FeSO47H2O������ ��