题目内容
实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号): .
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶
⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度的影响(偏高,偏低,或不变)
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号): .
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶
⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度的影响(偏高,偏低,或不变)
| A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。 |
| C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。 |
| D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。 |
(1)100mL。(2)②④⑥⑧(3)A偏低B 偏低 C 偏低D 偏低
试题分析:欲配制500mL的溶液,需用500mL的容量瓶。(1)需准确量取98%的硫酸的体积v=0.5L×3.68mol·L-1×98g/mol÷98%÷1.84g·cm-3=100mL;(2)量取98%的硫酸后,倒入烧杯,稀释,用玻璃棒进行搅拌,冷却至室温,转移入500mL 容量瓶,洗涤,定容,当距离刻度线1-2cm时改用胶头滴管,摇匀,则配制了一定浓度的溶液。故需用到的实验仪器有烧杯、玻璃棒、500mL 容量瓶和胶头滴管;(3)A烧杯和玻璃棒上面粘附有溶质,若没有洗涤或洗涤后洗涤液没有加入容量瓶,都会使所配制的溶液的浓度偏低;B部分稀硫酸外溅,溶质减小,故浓度偏低;C若加入过多的水,则使溶液的浓度偏小,将瓶内液体吸出,会吸出少量溶质,故溶液最终的浓度还是偏低,当加入过量的水时,只能倒掉重新配制;D 仰视时,溶剂过量,溶液的浓度偏低。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。

练习册系列答案
相关题目
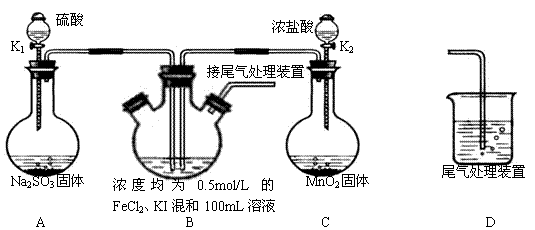
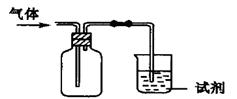
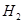 ②
②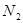 ③
③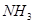 ④
④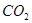 ⑤
⑤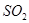 ⑥
⑥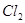 ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )