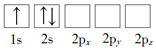
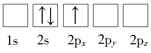
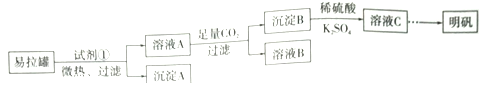
题目内容
【题目】一定条件下的可逆反应CO(g)+2H2(g)![]() CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是 ( )
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是 ( )

A. 温度:T1 < T2 3
B. 正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C. 平衡常数: K(a) =K(c) ; K(b) >K(d)
D. 平均摩尔质量:M(a)<m(c); m(b)>M(d)</m(c); m(b)>
【答案】A
【解析】A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A正确;B.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,故温度T1<T3,温度越高,反应速率越快,故υ(a)<υ(c);b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B错误;C.由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,故温度T1<T3,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C错误;D.CO转化率的越大,n总越小,由M=![]() 可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误;故选A。
可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D错误;故选A。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目