题目内容
【题目】晶体硅是良好的半导体材料,多晶硅主要采用SiHCl3还原工艺生产。
(1)硅原子核外有_____种能量不同的电子。氯离子的核外电子排布式为________________________。短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________。
(2)从原子结构角度解释硅元素与氯元素的非金属性强弱________________________。
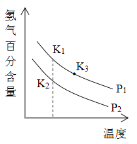
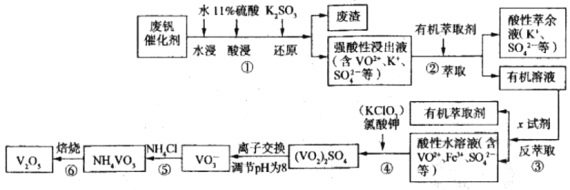
(3)900℃以上发生SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
(4)若反应容器的容积为2L,10min后达到平衡,测得固体的质量增加了2.8g,则HCl的平均反应速率为______________。
(5)P1____P2(选填“>”、“<”或“=”);K1、K2、K3大小关系式为___________。
【答案】5 1s22s22p63s23p6 S>Cl>F 氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅 氢气的生成速率等于氢气的消耗速率(合理即给分) 0.015mol/(Lmin) > K1=K2<K3
【解析】
(1)根据硅原子核外电子排布为1s22s22p63s23p2,确定核外有多少种能量不同的电子。根据氯原子得1个电子变为氯离子,写出氯离子核外电子排布式;根据同一主族,从上到下,原子半径增大,同一周期,从左到右,原子半径减小规律比较S、Cl、F半径大小;
(2) 同周期元素,从左到右,质子数越大,原子半径越小,原子核对最外层电子的吸引能力越强进行分析;
(3)化学平衡状态的特征是υ(正)=υ(逆)、各组分的浓度保持不变,据此进行分反应已达到平衡状态时,氢气的生成速率与氢气的消耗速率关系;
(4) 先计算出硅的变化量,据此求出n(HCl),根据υ(HCl)=c/t进行计算;
(5) 当温度不变时,压强由P2变为P1,氢气的百分含量增大,说明平衡左移,据此分析P1与P2的关系;平衡常数只是温度的函数,据此进行分析。
(1) 硅原子核电荷数为14,核外电子排布为1s22s22p63s23p2,据此可知硅原子核外有5种能量不同的电子;氯原子核电荷数为17,核外电子排布为1s22s22p63s23p5,氯原子得一个电子变为氯离子,氯离子的核外电子排布式为1s22s22p63s23p6;短周期主族元素中,氯元素及与其相邻元素的原子分别为硫和氟,同一主族,从上到下,原子半径增大,同一周期,从左到右,原子半径减小,半径从大到小的顺序是S>Cl>F;
综上所述,本题答案是:5,1s22s22p63s23p6,S>Cl>F。
(2) 氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅,所以氯元素的非金属性强于硅元素;
综上所述,本题答案是:氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅。
(3)化学平衡状态的特征是υ(正)=υ(逆) 、各组分的浓度保持不变,所以上述反应已达到平衡状态时,氢气的生成速率等于氢气的消耗速率;
综上所述,本题答案是:氢气的生成速率等于氢气的消耗速率(合理即给分)。
(4) 根据SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)可知,10min后达到平衡,测得固体硅的质量增加了2.8g,即0.1mol,生成n(HCl)=0.3mol,所以HCl的平均反应速率为0.3mol/(2L×10min)= 0.015mol/(Lmin);
Si(s)+3HCl(g)可知,10min后达到平衡,测得固体硅的质量增加了2.8g,即0.1mol,生成n(HCl)=0.3mol,所以HCl的平均反应速率为0.3mol/(2L×10min)= 0.015mol/(Lmin);
综上所述,本题答案是:0.015mol/(Lmin)。
(5)当温度不变时,压强由P2变为P1,氢气的百分含量增大,说明平衡左移,增大压强平衡逆向移动,所以P1>P2;平衡常数只是温度的函数,因为K1、K2所处温度相同,所以K1=K2;温度升高,氢气的百分含量减小,平衡右移,正反应为吸热反应,所以K3>K1=K2;
综上所述,本题答案是:>;K1=K2<K3。

 应用题作业本系列答案
应用题作业本系列答案