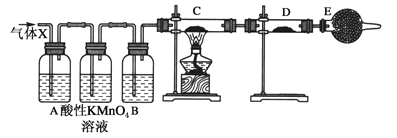
题目内容
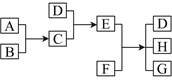
【题目】已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如下 图所示:
(1)、B在A中燃烧的实验现象为___________,其化学方程式为_____________。
(2)、实验室可用C的浓溶液与一种黑色粉末反应制取A,该反应的离子方程式______________,若反应中转移0.5 mol电子,则生成A的体积(标准状况)为__________L,被氧化的C的物质的量为_________mol。
(3)、E和F反应生成D、H和G的化学方程式为______________,实验室可通过多种方法制备D,用下图所示装置收集D,下列关于制取及收集D实验的叙述正确的是______________(填序号)。
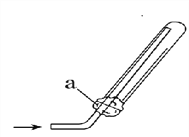
①D气体不能用排水法收集
②实验室用E一种药品可以制取D
③右图中的a为浸有稀H2SO4的棉花
④可用D的浓溶液和生石灰为原料制取D
【答案】安静地燃烧、产生苍白色火焰、瓶口有白雾H2+Cl2![]() 2HClMnO2+4H++2Cl-
2HClMnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O5.6L0.5mol2NH4Cl+Ca(OH)2
Mn2++Cl2↑+2H2O5.6L0.5mol2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O①③④
CaCl2+2NH3↑+2H2O①③④
【解析】
G是氯化钙,固体E和F反应生成氯化钙,且生成物是三种,因此该反应可能是实验室制取氨气的方程式。则D是氨气,C就是氯化氢,E是氯化铵,F是熟石灰,A和B是氢气和氯气。
(1)氢气在氯气中燃烧的实验现象为安静地燃烧、产生苍白色火焰、瓶口有白雾,其化学方程式为H2+Cl2![]() 2HCl,故答案为:安静地燃烧、产生苍白色火焰、瓶口有白雾;H2+Cl2
2HCl,故答案为:安静地燃烧、产生苍白色火焰、瓶口有白雾;H2+Cl2![]() 2HCl;
2HCl;
(2)实验室可用浓盐酸与二氧化锰反应制取氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,若反应中转移0.5 mol电子,生成氯气0.25mol,标准状况下的体积为0.25mol×22.4L/mol=5.6L,被氧化的氯化氢的物质的量为0.5mol,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,若反应中转移0.5 mol电子,生成氯气0.25mol,标准状况下的体积为0.25mol×22.4L/mol=5.6L,被氧化的氯化氢的物质的量为0.5mol,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O; 5.6;0.5;
Mn2++Cl2↑+2H2O; 5.6;0.5;
(3)E和F反应生成D、H和G的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;D是氨气,①氨气极易溶于水,不能用排水法收集,正确;②加热氯化铵不能制得氨气,分解生成的氨气和氯化氢又化合生成氯化铵,错误;
CaCl2+2NH3↑+2H2O;D是氨气,①氨气极易溶于水,不能用排水法收集,正确;②加热氯化铵不能制得氨气,分解生成的氨气和氯化氢又化合生成氯化铵,错误;
③氨气能够被稀硫酸吸收,可以防止氨气污染空气,正确;右图中的a为浸有稀H2SO4的棉花
④生石灰与水反应生成氢氧化钙,反应放热,浓氨水分解生成氨气,因此可以用浓氨水与生石灰反应制取氨气,正确;故选①③④。