题目内容
工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:
2FeCl3 + Cu = 2FeCl2 + CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
2FeCl3 + Cu = 2FeCl2 + CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
| A.0.5mol·L—1 | B.1.5 mol·L—1 | C.0.4 mol·L—1 | D.0.25 mol·L—1 |
B
试题分析:根据反应方程式2FeCl3 + Cu = 2FeCl2 + CuCl2,设CuCl2的物质的量浓度为a ,则FeCl2 的物质的量浓度为2a,根据电荷守恒:3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),c(Cl-)="17.22g÷143.5" g·molˉ1
÷0.01L="12" mol·L—1,可得:3×1+2×2a+2a=12,故a=1.5,即c(Cu2+)="1.5" mol·L—1。

练习册系列答案
相关题目
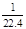 NA
NA