题目内容
【题目】由几种离子化合物组成的混合物中含有以下离子中的若干种:K+、Cl-、NH![]() 、Mg2+、Ba2+、CO
、Mg2+、Ba2+、CO![]() 、SO
、SO![]() 。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体1.12 L(标准状况下) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
请回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定100 mL溶液中一定存在的阴离子及其物质的量浓度(可不填满)。
阴离子符号 | 物质的量浓度(mol·L-1) |
_______ | ___________ |
______ | _______________ |
(3)K+是否存在?________(填“存在”或“不存在”),判断的理由是____________________。
【答案】 不能确定 Ba2+、Mg2 SO![]() 0.1 CO
0.1 CO![]() 0.2 存在 溶液中肯定存在的离子是NH
0.2 存在 溶液中肯定存在的离子是NH![]() 、CO
、CO![]() 和SO
和SO![]() 。经计算,100 mL溶液中NH
。经计算,100 mL溶液中NH![]() 的物质的量为0.05 mol,CO
的物质的量为0.05 mol,CO![]() 、SO
、SO![]() 的物质的量分别为0.02 mol、0.01 mol,根据电荷守恒可判断K+一定存在
的物质的量分别为0.02 mol、0.01 mol,根据电荷守恒可判断K+一定存在
【解析】试题分析:根据题意,Ba2+和SO42-,可发生离子反应生成BaSO4↓,因此两者不能共存.Ba2+和CO32-可发生离子反应生成BaCO3↓,因此两者也不能共存,第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.05mol,和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-═NH3↑+H2O,产生NH3为0.05mol,可得NH4+也为0.05mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.由条件可知BaSO4为2.33g,物质的量为![]() =0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为
=0.01mol,BaCO3为6.27g-2.33g═3.94g,物质的量为![]() =0.02mol.由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;一定不存在Mg2+、Ba2+;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量="0.01" mol时,溶液中不含有Cl-;
=0.02mol.由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;一定不存在Mg2+、Ba2+;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.01 mol,当K+物质的量>0.01 mol时,溶液中还必须含有Cl-;当K+物质的量="0.01" mol时,溶液中不含有Cl-;
(1)实验1加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO4
由上述分析可知,溶液中一定不含有Mg2+、Ba2+;答案为:不能确定;Mg2+、Ba2+;
(2)依据上述分析可知,溶液中一定存在的阴离子为CO32-、SO42-,
SO42-物质的量为0.01mol,SO42-物质的量浓度=![]() =0.1mol/L,
=0.1mol/L,
CO32-物质的量为0.02mol,CO32-物质的量浓度为![]() =0.2mol/L,答案为:
=0.2mol/L,答案为:
阴离子符号 | 物质的量浓度(mol·L-1) |
SO42-(1分) | 0.1(2分) |
CO32-(1分) | 0.2(2分) |
(3)溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol.CO32-、SO42-所带负电荷分别为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在,答案为:存在;溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol;CO32-、SO42-所带负电荷为0.02mol×2+0.01mol×2=0.06mol,NH4+所带正电荷为0.05 mol,根据溶液中电荷守恒,可知K+一定存在。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
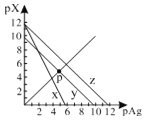
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012