题目内容
在一定条件下,反应N2 + 3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7 g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7 g,则反应速率为
| A.v(H2)="0.03" mol/(L·min) | B.v(N2)="0.02" mol/(L·min) |
| C.v(NH3)="0.01" mol/(L·min) | D.v(NH3)="0.17" mol/(L·min) |
C
解析试题分析:1.7g氨气的物质的量是1.7g÷17/mol=0.1mol,则氨气的浓度是0.1mol÷2L=0.05mol/L,所以氨气的反应速率是0.05mol/L÷5min=0.01 mol/(L·min),选项C正确,D不正确;又因为反应速率之比是相应的化学计量数之比,则氢气和氮气反应速率分别是0.015 mol/(L·min)和0.005 mol/(L·min),选项AB不正确,答案选C。
考点:考查反应速率的计算
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。该题的关键是明确反应速率的含义和计算依据,特别是反应速率与化学计量数的关系,有利于培养学生的逻辑推理能力,有助于提高学生的学习效率。

对化学反应限度的叙述,错误的是
| A.任何可逆反应都有一定的限度 |
| B.化学反应达到限度时,正逆反应速率相等 |
| C.化学反应的限度与时间的长短无关 |
| D.化学反应的限度是不可改变的 |
下列叙述中可以说明反应2HI(g)  H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI ②一个H—H键断裂的同时有两个H—I键断裂 ③百分组成HI%=I2% ④反应速率v(H2)=v(I2)=1/2v(HI) ⑤[HI]∶[H2]∶[I2]=2∶1∶1 ⑥v(HI)分解=v(HI)生成 ⑦压强不变
| A.①③⑤ | B.②⑥ | C.④⑤ | D.④⑥⑦ |
在体积不变的密闭容器中,2NO2(g)  N2O4(g) 达到平衡的标志是
N2O4(g) 达到平衡的标志是
①消耗1 mol NO2的同时消耗1 mol N2O4 ②容器内NO2 和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化
| A.①② | B.①②③ | C.③④ | D.①③④ |
COCl2(g)  CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
| A.①②④ | B.①④⑥ |
| C.②③⑤ | D.③⑤⑥ |
下列关于判断过程的方向的说法正确的是 ( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO 4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液 /mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O /mL | V7 | V8 | V9 | V10 | 10 | 0 |
② 该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
对下列图像的描述正确的是( )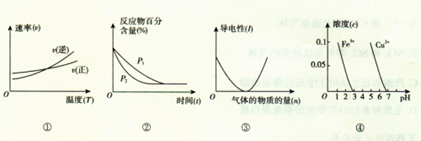
A.根据图①可判断反应A2(g)+3B2(g)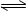 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强(P)对反应2A(g)+2B(g)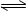 3C(g)+D(s)的影响 3C(g)+D(s)的影响 |
| C.图③可表示向醋酸溶液通人氨气时,溶液导电性随氨气量的变化 |
| D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 |
