题目内容
(1)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg
.
中性溶液的AG=
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列两个热化学反应方程式:
FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-218kJ/mol
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
| c(H+) | c(OH-) |
中性溶液的AG=
0
0
.常温下0.01mol?L-1盐酸溶液的AG=10
10
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列两个热化学反应方程式:
FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-218kJ/mol
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
.分析:(1)依据题干信息,结合溶液中的氢离子和氢氧根离子浓度,水溶液中存在的离子积常数分析计算;
(2)依据盖斯定律结合所给热化学方程式计算书写符合要求的热化学方程式;
(2)依据盖斯定律结合所给热化学方程式计算书写符合要求的热化学方程式;
解答:解:(1)根据酸度的表示方法,酸度(AG)AG=lg
.中性溶液中C(H+)=C(OH-),AG=lg
=0;常温下0.01mol?L-1盐酸溶液中,C(H+)?C(OH-)=10-14,溶液中C(H∪)=10-2mol/L
C(OH-)=
=10-12mol/L,所以溶液的酸度AG=lg
=lg
=lg1010=10;
故答案为:0 10
(2)①FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-218kJ/mol
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
根据盖斯定律,①×3+②得到:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
故答案为:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
C(OH-)=
| 10-14 |
| 10-2 |
| c(H+) |
| c(OH-) |
| 10-2mol/L |
| 10-12mol/L |
故答案为:0 10
(2)①FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-218kJ/mol
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol
根据盖斯定律,①×3+②得到:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
故答案为:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5KJ/mol;
点评:本题考查了溶液酸度的信息应用和溶液酸度的计算,水溶液中的离子积常数的计算应用,盖斯定律的应用和热化学方程式的书写原则和注意问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
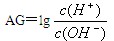 。
。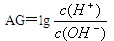 。
。