题目内容
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
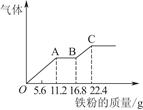

| A.原混合酸中NO物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol/L |
D
向混合溶液中加入铜粉,反应为8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O,能溶解0.3 mol Cu,则HNO3的物质的量大于等于0.2 mol,可知OA段反应为4H++NO3-+Fe=Fe3++NO↑+2H2O,气体产物为NO,AB段反应为2Fe3++Fe=3Fe2+,说明A点时NO3-已反应完全,溶液中n(HNO3)=n(Fe)=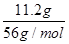 =0.2 mol,c(HNO3)=
=0.2 mol,c(HNO3)=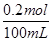 =2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=
=2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=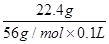 =4 mol/L,D项错误。
=4 mol/L,D项错误。
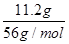 =0.2 mol,c(HNO3)=
=0.2 mol,c(HNO3)=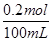 =2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=
=2 mol/L,A项正确;BC段反应为Fe+2H+=Fe2++H2↑,B项正确;第二份溶液中NO3-已反应完全,故溶液中最终溶质为FeSO4,C项正确;c(H2SO4)=c(FeSO4)=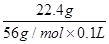 =4 mol/L,D项错误。
=4 mol/L,D项错误。
练习册系列答案
相关题目
 aTiCl4+cCO……反应①
aTiCl4+cCO……反应① Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。 K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)
K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)