题目内容
【题目】(1)已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:_____________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497 kJ/mol。 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,NO分子中化学键的键能为_____ kJ/mol。
(4)S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
③S(单斜,s)=S(正交,s) ΔH3=_____。
S(单斜,s)比S(正交,s)更_________(填“稳定”或“不稳定”)
(5)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1___________ΔH2。(用“>”、“<”或“=”填空)
(6)相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。(用“>”、“<”或“=”填空)
【答案】S(g)+O2(g)=SO2(g) △H=-298 kJ/mol △H=+226.7 kJ/mol 631.5 kJ/mol -0.33 kJ/mol 不稳定 = >
【解析】
(1)先根据n=![]() 计算16 g S的物质的量,然后结合燃烧热的概念书写表示物质燃烧热的热化学方程式;
计算16 g S的物质的量,然后结合燃烧热的概念书写表示物质燃烧热的热化学方程式;
(2)将已知的热化学方程式叠加,可得待求反应的热化学方程式;
(3)根据反应热等于反应物总键能与生成物总键能的差计算NO分子中化学键的键能;
(4)根据盖斯定律,将已知热化学方程式叠加,可得单斜硫与正交硫转化的热化学方程式然后进行判断;依据物质含有的能量越低,物质的稳定性越强分析判断;
(5)根据盖斯定律分析比较;
(6)根据断裂化学键吸收能量,形成化学键释放能量分析比较。
(1)16 g S的物质的量n(S)=![]() =0.5 mol,0.5 mol S完全燃烧产生SO2气体放出热量149 kJ,则1 mol S完全燃烧产生SO2气体放出热量Q=2×149 kJ=298 kJ,故S燃烧热的热化学方程式为S(g)+O2(g)=SO2(g),△H=-298 kJ/mol;
=0.5 mol,0.5 mol S完全燃烧产生SO2气体放出热量149 kJ,则1 mol S完全燃烧产生SO2气体放出热量Q=2×149 kJ=298 kJ,故S燃烧热的热化学方程式为S(g)+O2(g)=SO2(g),△H=-298 kJ/mol;
(2)①C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,①×4+②-③,整理可得4C(石墨,s)+2H2(g)=2C2H2(g) ΔH3=+453.4 kJ/mol,所以2C(石墨,s)+H2(g)=C2H2(g) ΔH3=+226.7 kJ/mol;
(3)根据反应热等于反应物总键能与生成物总键能的差,假设NO中键能为x,可知946 kJ/mol+497 kJ/mol-2×x=+180.0 kJ/mol,解得x=631.5 kJ/mol;
(4)①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
根据盖斯定律,将①-②,整理可得S(单斜,s)= S(正交,s) ΔH=ΔH1-ΔH2=-0.33 kJ/mol;
根据该热化学方程式可知:单斜硫转化为正交硫放出热量,说明正交硫能量比单斜硫的能量低,物质含有的能量越低,物质的稳定性就越强,故单斜硫不如正交硫的稳定性强;
(5)反应热只与反应的温度、物质的状态有关,而与反应条件无关,所以同温同压下,在光照和点燃条件下的H2(g)+Cl2(g)=2HCl(g)ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1=ΔH2;
(6)由于键能是形成1 mol化学键所释放的能量或断裂1 mol化学键所吸收的能量,说明含有化学键的分子所具有的能量比形成该化学键的原子的能量低,因此在相同条件下,2 mol氢原子所具有的能量比1 mol氢分子所具有的能量高。

【题目】观察如图所示装置,可发现电流计指针偏转,M棒变粗,N棒变细.下表所列的M、N、P对应物质可构成该装置的是( )
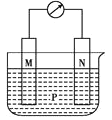
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D