题目内容
19.下列各组物质中,满足表中图示物质在一定条件下,不能一步实现转化的是( )| 序号 | X | Y | Z | W |  |
| A | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| B | Cl2 | Ca(ClO)2 | HClO | HCl | |
| C | Si | SiO2 | Na2SiO3 | H2SiO3 | |
| D | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaOH中通少量二氧化碳生成Na2CO3、碳酸钠溶液继续通二氧化碳生成NaHCO3、碳酸氢钠与盐酸反应生成NaCl,电解氯化钠溶液可得到氢氧化钠;
B.Cl2与Ca(OH)2反应可生成Ca(ClO)2,盐酸酸性比次氯酸强,所以Ca(ClO)2中加入盐酸可生成次氯酸,HClO见光分解可生成HCl,浓HCl溶液与二氧化锰加热可生成氯气;
C.H2SiO3分解只能一步生成SiO2,不能直接得到硅;
D.FeCl3被铁还原生成FeCl2,氯化亚铁与氢氧化钠生成Fe(OH)2的白色沉淀,氢氧化亚铁在空气中被氧化成红褐色的Fe(OH)3沉淀,氢氧化铁与盐酸溶解又生成氯化铁.
解答 解:A.NaOH$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{CO_{2}H_{2}O}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl$\stackrel{电解溶液}{→}$NaOH,转化均可实现,故A正确;
B.Cl2$\stackrel{Ca(OH)_{2}}{→}$Ca(ClO)2$\stackrel{HCl}{→}$HClO$\stackrel{光照}{→}$HCl,浓HCl溶液$\stackrel{MnO_{2}}{→}$Cl2,转化均可实现,故B正确;
C.Si$\stackrel{O_{2}}{→}$SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3$\stackrel{△}{→}$SiO2,由H2SiO3不能一步转化得到硅单质,故C错误;
D.FeCl3$\stackrel{Fe}{→}$FeCl2$\stackrel{NaOH}{→}$Fe(OH)2$\stackrel{O_{2}H_{2}O}{→}$Fe(OH)3$\stackrel{HCl}{→}$FeCl3,转化均可实现,故D正确;
故选C.
点评 本题考查元素化合物知识,题目难度不大,本题注意把握常见物质的性质,学习中注重相关基础知识的积累即可解答该题.

| A. | 14C与12C60中碳原子化学性质相同 | B. | 14C与14N的质量数相同 | ||
| C. | 14C是12C60的同素异形体 | D. | 14C与12C、13C互为同位素 |
| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 1:2 |
| A. | 42% | B. | 48% | C. | 51% | D. | 65% |
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
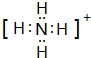 ,B-的化学式为OH-.
,B-的化学式为OH-. 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.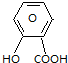 $\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N
$\stackrel{NaHCO_{3}溶液}{→}$X$\stackrel{NaOH溶液}{→}$Y$\stackrel{CO_{2}}{→}$Z$\stackrel{HCl}{→}$M$→_{浓H_{2}SO_{4}△}^{CH_{3}OH酯化}$N ,Y
,Y ,Z
,Z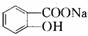 ,M
,M ,N
,N .
.