题目内容
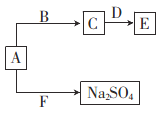
【题目】实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等。甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示。


图1 图2
(1)①事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填序号,下同)。
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)=2H2O(l) ΔH<0
c.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
②甲同学设计的原电池,若将石墨棒改为铁片,则总电极反应式是否改变,若是,写出改变后总的电极反应式,若否,请写出理由:_______________________。
③乙同学设计的原电池电极反应与甲的相同,但电池的效率高很多。乙同学设计的原电池两电极分别为:a是_______(填“铜片”“铁片”或“石墨棒”,下同),b是__________。负极的电极反应式为___________________,正极的电极反应式为____________________。
(2)关于乙同学设计的原电池,下列说法中错误的是____________。
a.实验过程中,左侧烧杯中Cl浓度增大
b.实验过程中取出盐桥,原电池不能继续工作
c.电子通过盐桥从右侧烧杯进入左侧烧杯中
【答案】(13分)
(1)①b(2分) ②2FeCl3+Fe=3FeCl2(或2Fe3++Fe=3Fe2+)(3分)
③铜片(1分) 石墨棒(1分)
Cu-2e-=Cu2+(2分) 2Fe3++2e-=2Fe2+(2分)
(2)c(2分)
【解析】(1)①根据题中信息,设计成原电池的反应通常是放热反应,排除a,根据已学知识,原电池反应必是自发进行的氧化还原反应,排除c。②若将石墨棒改为铁片,则铁的活泼性强于铜,总电极反应发生改变。③因为乙同学设计的原电池总电极反应与甲同学的相同,均为Cu+2Fe3+=2Fe2++Cu2+,因此两电极为铜片和石墨棒,再根据电解液即可确定两电极的材料。
(2)该原电池的工作原理是Cu+2Fe3+= Cu2++2Fe2+,盐桥起形成闭合回路和平衡电荷的作用,因此当电池工作时,盐桥中的Cl向负极移动,因此左侧烧杯中Cl的浓度将增大,a正确。当取出盐桥,不能形成闭合回路,电池处于断路状态,不能继续工作,b正确。电子只能通过导线传递,盐桥传递的是离子,c错误。

【题目】用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是( )
A.给反应体系适当加热
B.向反应体系中加水稀释
C.加入少量氧化铜固体
D.加压
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Cl—Cl | Cl—H |
键能/(kJ·mol-1) | 436 | 243 | 431 |
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A. +862 kJ·mol-1 B. +679 kJ·mol-1 C. -183 kJ·mol-1 D. +183 kJ·mol-1