题目内容
7.等物质的量的SO2和SO3相比较,下列结论错误的是( )| A. | 它们的质量之比为 1:1 | B. | 它们的氧原子数目之比为 2:3 | ||
| C. | 它们的分子数目之比是 1:1 | D. | 它们所含原子数目之比为 3:4 |
分析 A、根据m=nM可知物质的量相同时,质量之比等于物质的摩尔质量之比;
B、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算氧原子数之比分析;
C、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比;
D、根据N=nNA可知物质的量相同时,分子数之比等于物质的量之比,再计算原子数之比分析;
解答 解:A、等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故A错误;
B、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故B正确;
C、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,故C正确;
D、等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故D正确;
故选:A.
点评 本题考查有关物质的量的计算,并结合原子、分子个数的计算方法解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.标准状况下两个容积相等的储气瓶,一个装有CH4,另一个装有CO和CO2的混合气体,两瓶内的气体,一定相同的是( )
| A. | 质量 | B. | 原子总数 | C. | 碳原子数 | D. | 密度 |
15.下列物质中互为同系物的是( )
| A. | CH3-CH3CH3-CH2-CH3 | B. | 白磷、红磷 | ||
| C. | 氕、氚 | D. | 丁烷,异丁烷 |
2.下列常见现象与胶体无关的是( )
| A. | 清晨在密林中看到一缕缕的光束 | |
| B. | 向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐 | |
| C. | 利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上 | |
| D. | FeCl3溶液加入NaOH溶液产生红褐色沉淀 |
12.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一.对下列实验事实的解释正确的是( )
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
| A. | A | B. | B | C. | C | D. | D |
16.体积为VmL,密度为dg•cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol•L-1,质量分数为w,下列表达式正确的是( )
| A. | c=$\frac{w×1000×d}{M}$ | B. | m=V×d×$\frac{w}{100}$ | C. | w=$\frac{c×M}{1000×d}$% | D. | c=$\frac{1000×m}{V×M}$ |
17.下列实验符合安全要求且能达到实验目的是( )
| A. | 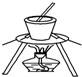 从食盐水中提取NaCl | B. | 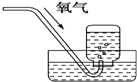 收集氧气 | ||
| C. | 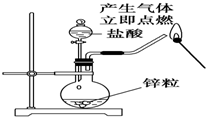 制备并检验氢气的可燃性 | D. | 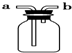 从a口进气可收集H2 |