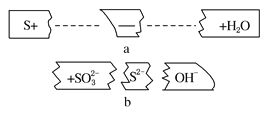
题目内容
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向大量沸腾的蒸馏水中逐滴加入___________溶液,继续煮沸至________________________________,停止加热,可制得Fe(OH)3胶体;
(2)向Fe(OH)3胶体中滴加氢碘酸(HI水溶液)至过量,观察到的现象为________________________________________,该反应的离子方程式为________________________________________________________;
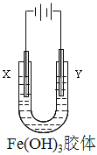
(3)如由图所示,通电后,Fe(OH)3胶体粒子向_________电极移动(填“X”或“Y”)。
【答案】饱和FeCl3溶液 液体呈红褐色 先产生红褐色沉淀,然后沉淀逐渐溶解,最终得到澄清的棕黄色溶液 2Fe(OH)3+ 2I- +6 H+ =2Fe2+ + I2+ 6H2O X
【解析】
Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色,根据Fe(OH)3胶体的制备过程结合胶体的性质分析解答。
(1)Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液,继续煮沸至溶液呈红褐色,FeCl3+3 H2O ![]() Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,故答案为:饱和氯化铁溶液;液体呈红褐色;
Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,故答案为:饱和氯化铁溶液;液体呈红褐色;
(2)向Fe(OH)3胶体中滴加氢碘酸(HI水溶液)至过量,首先发生胶体的聚沉,然后氢氧化铁沉淀被氢碘酸溶解,溶解的同时发生氧化还原反应生成碘和碘化亚铁,观察到的现象为先产生红褐色沉淀,然后沉淀逐渐溶解,最终得到澄清的棕黄色溶液,反应的离子方程式为2Fe(OH)3+ 2I- +6 H+ =2Fe2+ + I2+ 6H2O,故答案为:先产生红褐色沉淀,然后沉淀逐渐溶解,最终得到澄清的棕黄色溶液;2Fe(OH)3+ 2I- +6 H+ =2Fe2+ + I2+ 6H2O;
(3)氢氧化铁胶体粒子带有正电荷,通电后,Fe(OH)3胶体粒子向阴极移动,即向X极移动,故答案为:X。

【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为: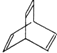
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:
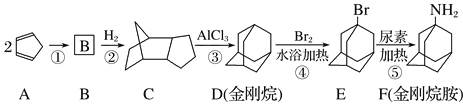
已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。