题目内容
今有如下三个热化学方程式:
H2(g)+ O 2(g)==H2O(g) ΔH="a" kJ·mol-1;
O 2(g)==H2O(g) ΔH="a" kJ·mol-1;
H2(g)+ O 2(g)==H2O(l) ΔH="b" kJ·mol-1;
O 2(g)==H2O(l) ΔH="b" kJ·mol-1;
2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1。
关于它们的下列表述正确的是
H2(g)+
 O 2(g)==H2O(g) ΔH="a" kJ·mol-1;
O 2(g)==H2O(g) ΔH="a" kJ·mol-1;H2(g)+
 O 2(g)==H2O(l) ΔH="b" kJ·mol-1;
O 2(g)==H2O(l) ΔH="b" kJ·mol-1;2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1。
关于它们的下列表述正确的是
| A.a<b | B.a、b、c均为正值 | C.a=b | D.2b=c |
D
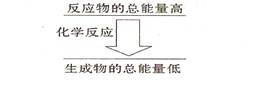
氢气的燃烧反应为放热反应,反应热的值为“—”;即B错;由于气态水转化为液态水要放出热量,所以可得a>b,即A错;C错;H2(g)+ O 2(g)==H2O(l) ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
O 2(g)==H2O(l) ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
 O 2(g)==H2O(l) ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
O 2(g)==H2O(l) ΔH="b" kJ·mol-1;与反应2H2(g)+O2(g)====2H2 O(l) ΔH="c" kJ·mol-1的物质的量相差2倍关系,即可得2b=c;
练习册系列答案
相关题目
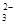 存在;
存在; 2C(g) △H=QkJ·mol-1(Q<0)
2C(g) △H=QkJ·mol-1(Q<0)
 O2(g)=H2O(l) ΔH4;
O2(g)=H2O(l) ΔH4;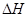 的绝对值均正确)
的绝对值均正确)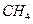 (g)+
(g)+ 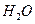 (g)====
(g)====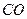 (g)+
(g)+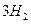 (g)
(g)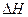 =
= 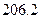
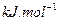
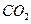 (g)====
(g)====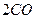 (g)+
(g)+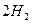 (g)
(g)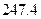
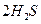 (g)====
(g)====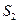 (g)
(g) 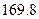
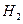 (g)的热化学方程式为______。
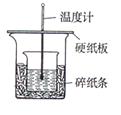
(g)的热化学方程式为______。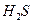 热分解制氢时,常向反应器中通入一定比例空气,使部分
热分解制氢时,常向反应器中通入一定比例空气,使部分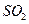 与
与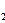 O的热分解也可得到H
O的热分解也可得到H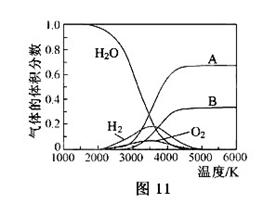


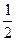 O2(g) = H2O(l) △H = -285.8 kJ / mol
O2(g) = H2O(l) △H = -285.8 kJ / mol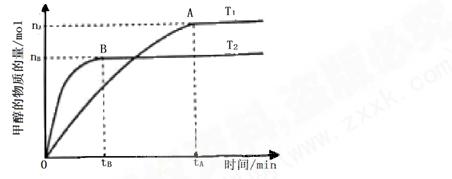
 号)
号)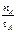 mol·L-1·min-1
mol·L-1·min-1 增大
增大