题目内容
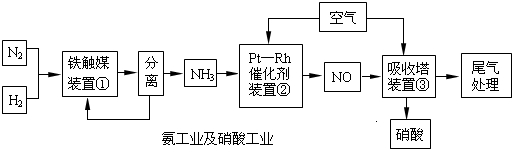
工业合成氨与制备硝酸一般可连续生产,流程如下:

完成下列问题:
Ⅰ.合成氨
(1)写出装置①中发生反应的化学方程式:______.
(2)已知在一定的温度下进入装置①的氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,则氮的转化率为______.
Ⅱ.氨的接触氧化原理
(3)在900℃装置②中反应有:?
4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905.5kJ?mol-1 K1=1×1053 (900℃)
4NH3(g)+4O2(g)?4N2O(g)+6H2O(g);△H=-1103kJ?mol-1 K2=1×1061 (900℃)
4NH3(g)+3O2(g)?2N2(g)+6H2O(g);△H=-1267kJ?mol-1 K3=1×1067 (900℃)
除了上列反应外,氨和一氧化氮相互作用:
4NH3(g)+6NO(g)?5N2(g)+6H2O(g);△H=-1804kJ?mol-1,还可能发生氨、一氧化氮的分解.
完成热化学方程式:2NO(g)?N2(g)+O2(g);△H=______.
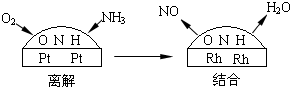
(4)铂-铑合金催化剂的催化机理为离解和结合两过程,如图所示:

由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中.若没有使用铂-铑合金催化剂,氨氧化结果将主要生成______.说明催化剂对反应有______.
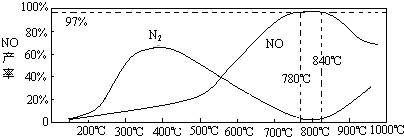
(5)温度对一氧化氮产率的影响

当温度大于900℃时,NO的产率下降的原因______(选填序号)
A.促进了一氧化氮的分解
B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
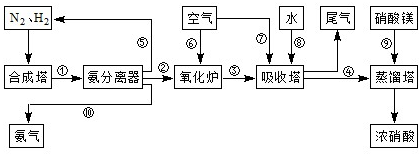
(6)硝酸工业的尾气常用Na2CO3溶液处理,尾气的NO、NO2可全部被吸收,写出用Na2CO3溶液吸收的反应方程式______.
解:(1)氮气的氢气在催化剂、加热加压的条件下生成氨气的反应为:N2+3H2  2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 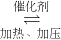 2NH3;
2NH3;
(2)解:设消耗的氮气的量是x,则N2 +3H2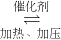 2NH3
2NH3
初始物质的量 1 3 0
变化的物质的量 x 3x 2x
平衡时的物质的量 1-x 3-3x 2x
氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,即氮、氢混合气体的物质的量之和与从合成塔出来的混合气体的物质的量之和的比为5:4,所以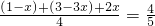 ,解得x=0.4mol,所以氮气的转化率为:
,解得x=0.4mol,所以氮气的转化率为: ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;
(3)根据已知反应可得:①2NO(g)+3H2O(g)?2NH3(g)+ O2(g);△H=
O2(g);△H= ×905.5kJ?mol-1=452.75kJ?mol-1,
×905.5kJ?mol-1=452.75kJ?mol-1,
②2NH3(g)+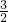 O2(g)?N2(g)+3H2O(g);△H=-1267×
O2(g)?N2(g)+3H2O(g);△H=-1267× kJ?mol-1=-633.5kJ?mol-1;
kJ?mol-1=-633.5kJ?mol-1;
反应2NO(g)?N2(g)+O2(g)可以看成是①+②的结果,所以△H=-633.5kJ?mol-1+452.75kJ?mol-1=-180.75 kJ?mol-1,故答案为:-180.75 kJ?mol-1;
(4)若没有使用铂-铑合金催化剂,氢气会和氧气反应,使得氮气和氢气不能反应,说明催化剂具有选择性,故答案为:氮气和水蒸气;选择性;
(5)由图象可知在温度较低时生成氮气.温度高于900℃时,NO产率下降是因为反应4NH3+5O2?4NO+6H2O是放热反应,达到平衡后,升温平衡逆向进行,故产率降低,
故答案为:A、B;
(6)尾气的NO、NO2可全部被碳酸钠吸收,其化学方程式为:NO+NO2+Na2CO3═2NaNO2+CO2、2NO2+Na2CO3═NaNO2+NaNO3+CO2,
故答案为:NO+NO2+Na2CO3═2NaNO2+CO2 、2NO2+Na2CO3═NaNO2+NaNO3+CO2.
分析:(1)氮气的氢气在催化剂、加热加压的条件下生成氨气;
(2)根据氮气氢气合成氨气的化学方程式进行计算;
(3)根据盖斯定律来计算反应的焓变;
(4)催化剂对反应的催化作用具有选择性;
(5)要结合图象来进行解答,对于生成NO的反应,一开始反应没有达到平衡,当NO达到最高点时,温度在升高,平衡就向着氨气减少的方向进行,反应物转化率下降.
点评:本题是一道工业合成氨的综合性知识题目,可以根据所学知识进行回答,难度较大.
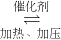 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 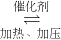 2NH3;
2NH3;(2)解:设消耗的氮气的量是x,则N2 +3H2
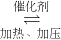 2NH3
2NH3初始物质的量 1 3 0
变化的物质的量 x 3x 2x
平衡时的物质的量 1-x 3-3x 2x
氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,即氮、氢混合气体的物质的量之和与从合成塔出来的混合气体的物质的量之和的比为5:4,所以
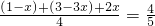 ,解得x=0.4mol,所以氮气的转化率为:
,解得x=0.4mol,所以氮气的转化率为: ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;(3)根据已知反应可得:①2NO(g)+3H2O(g)?2NH3(g)+
 O2(g);△H=
O2(g);△H= ×905.5kJ?mol-1=452.75kJ?mol-1,
×905.5kJ?mol-1=452.75kJ?mol-1,②2NH3(g)+
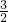 O2(g)?N2(g)+3H2O(g);△H=-1267×
O2(g)?N2(g)+3H2O(g);△H=-1267× kJ?mol-1=-633.5kJ?mol-1;
kJ?mol-1=-633.5kJ?mol-1;反应2NO(g)?N2(g)+O2(g)可以看成是①+②的结果,所以△H=-633.5kJ?mol-1+452.75kJ?mol-1=-180.75 kJ?mol-1,故答案为:-180.75 kJ?mol-1;
(4)若没有使用铂-铑合金催化剂,氢气会和氧气反应,使得氮气和氢气不能反应,说明催化剂具有选择性,故答案为:氮气和水蒸气;选择性;
(5)由图象可知在温度较低时生成氮气.温度高于900℃时,NO产率下降是因为反应4NH3+5O2?4NO+6H2O是放热反应,达到平衡后,升温平衡逆向进行,故产率降低,
故答案为:A、B;
(6)尾气的NO、NO2可全部被碳酸钠吸收,其化学方程式为:NO+NO2+Na2CO3═2NaNO2+CO2、2NO2+Na2CO3═NaNO2+NaNO3+CO2,
故答案为:NO+NO2+Na2CO3═2NaNO2+CO2 、2NO2+Na2CO3═NaNO2+NaNO3+CO2.
分析:(1)氮气的氢气在催化剂、加热加压的条件下生成氨气;
(2)根据氮气氢气合成氨气的化学方程式进行计算;
(3)根据盖斯定律来计算反应的焓变;
(4)催化剂对反应的催化作用具有选择性;
(5)要结合图象来进行解答,对于生成NO的反应,一开始反应没有达到平衡,当NO达到最高点时,温度在升高,平衡就向着氨气减少的方向进行,反应物转化率下降.
点评:本题是一道工业合成氨的综合性知识题目,可以根据所学知识进行回答,难度较大.

练习册系列答案
相关题目
工业合成氨与制备硝酸一般可连续生产,流程如图:
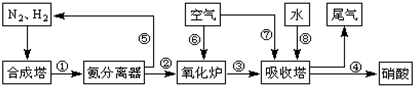
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)?CO2(g)+H2(g).t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.则该温度下此反应的平衡常数K= (填计算结果).
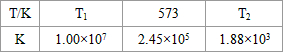
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1 300℃(填“>”、“<”或“=”).
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 .
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 .
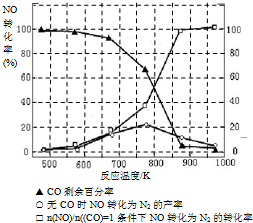
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如下图.据图分析,若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为 ;在
=1的条件下,应控制的最佳温度在 左右.

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)?CO2(g)+H2(g).t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.则该温度下此反应的平衡常数K=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如下图.据图分析,若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为
| n(NO) |
| n(CO) |

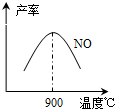 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因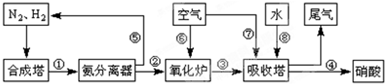
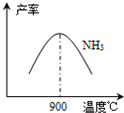 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因