题目内容
【题目】W、X、Y、Z是短周期中原子序数依次增大的4种元素,W与Y、X与Z处于同期表同一主族,W元素以W-W链化合物构成了生命界,Y元素以Y-X-Y链化合物构成了矿物界。
(1)W原子价电子的轨道表达式为_____________。
(2)WX的等电子体有N2、_______等。WN-与WX均为配合物中常见的配体,WN-作配体时,提供孤电子对的通常是W原子而不是氮原子,其原因是_________。
(3)ZX2的空间构型是______________。
(4)YF4遇水易发生水解,水解后产生的HF与部分YF4生成配离子YF62-,其反应的化学方程式为:3YF4+4H2O=H4YO4+2H2YF6。该反应混合物中,中心原子杂化方式相同的分子是_________。
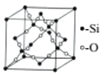
(5)一种石英晶体的晶胞结构如图所示,可以看成是在晶体硅的晶胞中每两个硅原子间插入一个氧原子而得到。其中硅原子的配位数为_______;己知该晶体的密度为ag/cm3,则该晶胞的棱长为______pm(用含a 、NA的代数式表示)。
【答案】 ![]() CN-(或NO+等) 碳元素的电负性小于氮元素的电负性 V形 SiF4、H2O、H4SiO4 4
CN-(或NO+等) 碳元素的电负性小于氮元素的电负性 V形 SiF4、H2O、H4SiO4 4 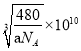
【解析】试题分析:本题以元素推断结果为载体,考查价电子的轨道式、等电子体、配合物知识、分子空间构型、原子杂化、晶体结构知识。
解析:以W-W链化合物构成了生命界的是C元素形成的有机物,所以W是C元素,则Y为Si元素,Y元素以Y-X-Y链化合物构成了矿物界是指矿物存在的Si—O—Si链,这也证明前一推断的正确性,则X为O,Z为S。
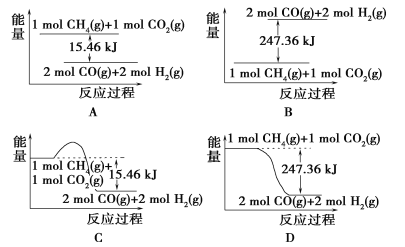
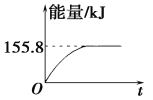
(1)C是6号元素,核外电子排布式为1s22s22p2,价电子为2s22p2,价电子轨道式为![]() 。正确答案:
。正确答案:![]() 。(2)WX是CO,原子数相等、价电子数相等的粒子包括N2、CN-、C22-等。CN-在形成配体时,由于C原子电负性比N原子电负性小,所以C原子对电子对的吸引能力较弱,也就比较容易提供用于形成配位键。正确答案:CN-(或C22-等)、碳元素的电负性小于氮元素的电负性。(3)ZX2是SO2,S原子成键电子对数目为2,孤对电子对数为(6-2×2)/2=1,价层电子对数为3,S采用sp2杂化,有一个杂化轨道容纳孤对电子,所以SO2空间构型为V形。正确答案:V形。(4)反应混合物中涉及SiF4、H2O、H4SiO4、H2SiF6四种物质,SiF4中心原子Si采用sp3杂化,H2O中心原子O采用sp3杂化,H4SiO4中心原子Si采用sp3杂化,H2SiF6中心原子Si采用sp3d2杂化。正确答案:SiF4、H2O、H4SiO4。(5)每1个Si原子周围相邻的O原子有4个,所以Si的配位数是4。晶胞中Si原子数8×1/8+6×1/2+4=8,O原子数16,晶胞总质量
。(2)WX是CO,原子数相等、价电子数相等的粒子包括N2、CN-、C22-等。CN-在形成配体时,由于C原子电负性比N原子电负性小,所以C原子对电子对的吸引能力较弱,也就比较容易提供用于形成配位键。正确答案:CN-(或C22-等)、碳元素的电负性小于氮元素的电负性。(3)ZX2是SO2,S原子成键电子对数目为2,孤对电子对数为(6-2×2)/2=1,价层电子对数为3,S采用sp2杂化,有一个杂化轨道容纳孤对电子,所以SO2空间构型为V形。正确答案:V形。(4)反应混合物中涉及SiF4、H2O、H4SiO4、H2SiF6四种物质,SiF4中心原子Si采用sp3杂化,H2O中心原子O采用sp3杂化,H4SiO4中心原子Si采用sp3杂化,H2SiF6中心原子Si采用sp3d2杂化。正确答案:SiF4、H2O、H4SiO4。(5)每1个Si原子周围相邻的O原子有4个,所以Si的配位数是4。晶胞中Si原子数8×1/8+6×1/2+4=8,O原子数16,晶胞总质量![]() ,设晶胞边长x pm,晶胞体积(x×10-10cm)3=x3×10-30cm3,
,设晶胞边长x pm,晶胞体积(x×10-10cm)3=x3×10-30cm3,
晶胞密度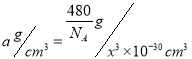 ,所以
,所以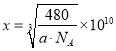 。正确答案:
。正确答案: 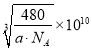 。
。