题目内容
【题目】铝是地壳中含量最多的金属元素,它性能稳定,供应充足,铝—空气电池具有能量密度高、工作原理简单、成本低、无污染等优点。铝—空气电池工作原理示意图如图:
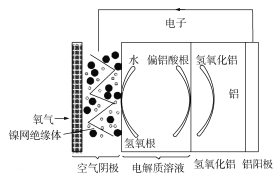
下列说法错误的是
A. 若是碱性电解质溶液中,则电池反应的离子方程式为:4Al+3O2+6H2O+4OH=4Al(OH)4-
B. 若是中性电解质溶液中,则电池反应的方程式为:4Al+3O2+6H2O=4Al(OH)3
C. 如果铝电极纯度不高,在碱性电解质溶液中会产生氢气
D. 若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,阳极产生6.72L气体
【答案】D
【解析】
A.若是碱性电解质,铝失去电子后与碱液中的OH反应,生成Al(OH)4-,反应方程式为4Al+3O2+6H2O+4OH=4Al(OH)4-,故A正确;
B.若是中性电解质,铝发生吸氧腐蚀失去电子,生成Al(OH)3,反应方程式为4Al+3O2+6H2O=4Al(OH)3,故B正确;
C.在碱液电解质溶液中,因铝纯度不高会形成原电池,发生析氢腐蚀,正极反应式为2H2O+2e=H2↑+2OH,故C正确;
D.若用该电池电解氯化钠溶液(石墨作电极),当负极减少5.4g时,转移0.6mol电子,但由于没说标况,所以阳极产生的气体体积不可知,故D错误;
故答案为D。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目